Значение - стандартный потенциал
Cтраница 1
Значения стандартных потенциалов для большинства металлов приведены в любом справочном материале. [1]
Значения стандартных потенциалов некоторых окислительно-восстановительных систем приведены на рис. 19.2. Пользуясь этими значениями, можно определить направление реакций окисления - восстановления, не прибегая к эксперименту. Окислителем в данной реакции всегда будет выступать частица, переход которой в низшую степень окисления характеризуется более высоким потенциалом; восстановителем является частица, переход окисленной формы которой в восстановленную характеризуется более низким потенциалом. [2]
Значение стандартного потенциала определяется не только природой данной окислительно-восстановительной системы, но также активностью частиц, представляющих высшую и низшую степени окисления элемента. [3]
Значения стандартных потенциалов используются для различных. В случаях, когда имеют место процессы восстановления, можно использовать эти значения непосредственно так, как они представлены в таблице стандартных потенциалов. [4]
Значение стандартного потенциала этой полуреакции показывает, что в водном растворе не могут существовать восстановленные формы редокспар, стандартный потенциал которых меньше - 0 81 В. Это, например, щелочные и щелочноземельные металлы, комплексный ион Сг ( СМ) б - - и др., которые восстанавливают воду, выделяя газообразный водород и образуя гидроксид-ионы. Есть довольно много пар, восстановленные формы которых должны давать эту реакцию, но, за исключением самых сильных восстановителей, реакции других восстановителей с водой проходят очень медленно и не имеют практического значения. [5]
Значение стандартного потенциала для 25 С, приведенное в табл. IX. [6]
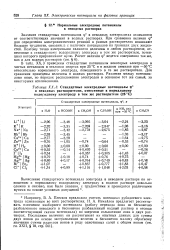 |
Стандартные электродные потенциалы р в неводных растворителях, отнесенные к нормальному водородному электроду в том же растворителе ( 25 С. [7] |
Значения стандартных потенциалов ф в неводных электролитах отличаются от соответствующих значений в водных растворах. При сравнении величин р для определения электрохимических реакций в разных растворителях возникают большие трудности, связанные с наличием потенциалов на границах двух жидкостей. Поэтому точно измеримыми являются величины в любом растворителе, отнесенные к стандартному водородному электроду в том же растворителе, потенциал которого приравнивают нулю. [8]
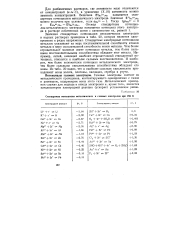 |
Стандартные потенциалы металлических и газовых электродов при 298 К. [9] |
Значения стандартных потенциалов металлических электродов в водных растворах приведены в табл. 20, которая является одновременно и рядом напряжения. Стандартные электродные потенциалы металлов указывают на меру восстановительной способности атомов металла и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильными восстановительными способностями обладает этот металл. Например, литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем более сильными окислительными способностями обладают его ионы. Из табл. 20 видно, что к наиболее сильным окислителям принадлежат ионы золота, платины, палладия, серебра и ртути. [10]
Значения стандартных потенциалов окислительно-восстановительных пар при 298 15 К, используемые при решении задач, приведены в табл. 3 Приложения. [11]
Значения стандартных потенциалов электродных процессов в неводных средах даны при температуре 25 С и давлении 1 атм. Потенциалы выражены в вольтах и отнесены к потенциалу стандартного водородного электрода в данном растворителе, принятому за нуль. [12]
Значения стандартных потенциалов ряда электродных реакций приведены в табл. 3.1, пользуясь которыми можно с помощью уравнения Нернста рассчитать равновесный потенциал электрода в растворе определенного состава. [13]
Значения стандартных потенциалов полуреакций восстановления водорода ( Еок) в различных средах приведены в разд. [14]
Используя значения стандартных потенциалов и уравнение Нернста рассчитайте константу равновесия реакции 5п2 2Ре3 ч 8п4 2Ре2, которая применяется при количественном определении железа в солянокислом растворе. [15]
Страницы: 1 2 3 4