Значение - стандартный потенциал
Cтраница 2
Однако значения стандартных потенциалов электродов в разных растворах можно сравнивать друг с другом, причем между значениями для различных электродов в выбранных четырех растворителях наблюдается отчетливый параллелизм. Стремление реакции итти в направлении М - М е, расту-щее вместе с величиной отрицательного потенциала электрода, во всех случаях имеет наибольшую величину у щелочных металлов и наименьшую-у благородных металлов, например серебра. [16]
Используя значение стандартных потенциалов восстановления 02 до надпероксид -, пероксид - и гидроксид-ионов, постройте диаграмму Латимера. [17]
Подставляя значения стандартных потенциалов реакций 5 и 9 - П в уравнения потенциалов и учитывая, что ан2о 1 и azn ( тв. [18]
Определение значения стандартного потенциала важно потому, что оно дает константу для вычислений, связанных с техническими показателями электролиза, а также определяет положение элемента в ряду напряжений. [19]
На основании значений стандартных потенциалов металлов ( см. табл. 2) к благородным металлам относятся золото, платина, палладий, иридий, родий и другие металлы платиновой группы. [20]
В неводных электролитах значения стандартных потенциалов ( / отличаются от соответствующих значений в водных растворах. При сравнении величин ф для определения электрохимических реакций в разных растворителях возникают большие трудности, связанные с потенциалами на границах двух жидкостей. [21]
Исходя только из значений стандартных потенциалов, нельзя с уверенностью предсказать возможность возникновения контактной коррозии двух металлов, так как потенциалы электродов работающих элементов могут сильно измениться вследствие поляризации и, кроме того, из-за окисных пленок. [22]
Исходя только из значений стандартных потенциалов, нельзя с уверенностью предсказать возможность возникновения контактной коррозии двух металлов, так как потенциалы электродов работающих элементов могут сильно измениться вследствие поляризации и, кроме того, из-за окисных пленок. [23]
Принимая во внимание это значение стандартного потенциала, можно легко понять, почему все попытки окислить Cm ( III) до Cm ( IV) в водном растворе с использованием таких сильных окислителей, как ноны бихромата, перманганата, персульфата, озон, ионы двухвалентного серебра и др., окончились неудачей. [24]
 |
Электродные потенциалы металлов в растворах, и в расплавах хлоридов, в. [25] |
В табл. 9.3 приведены значения стандартных потенциалов металлов в растворах электролитов, измеренных по сравнению с водородным электродом и потенциалов, измеренных в расплавах хлористых молей по сравнению со стеклянно-натриевым электродом. [26]
 |
Водородный стандартный электрод. [27] |
В табл. 3 приведены значения стандартных потенциалов ряда металлов, используемых в химических источниках тока, измеренных относительно водородного электрода, а также соответствующие окислительно-восстановительные реакции. Последовательность значений стандартных потенциалов носит название ряда напряжений. [28]
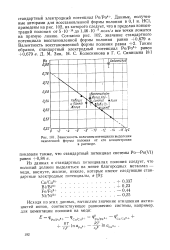 |
Зависимость величины потенциала выделения. [29] |
Согласно рис. 102, значение стандартного потенциала восстановленной формы полония равно 0 679 в. Таким образом, стандартный электродный потенциал Ро / Ро2 равен 0 679 в. [30]
Страницы: 1 2 3 4