Противоположная реакция
Cтраница 3
При исследовании химического превращения выяснилось, что состояние подвижного равновесия есть не состояние, а процесс, когда одновременно протекают две противоположные реакции. Предел наступает при одинаковых скоростях прямой и обратной реакций. [31]
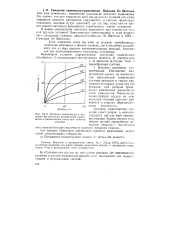 |
Влияние температуры и давления на состояние химического равновесия в реакционной смеси при синтезе аммиака. [32] |
Если изменить хотя бы одно из условий, определяющих состояние равновесия в данной системе, то в последней усиливается та из двух взаимно противоположных реакций, которая как бы противодействует вносимому изменению. [33]
В ] Если в смеси идеальных газов возможна реакция, изменяющая общее число молей, то изотермическое увеличение объема равновесной смеси вызывает ту из двух противоположных реакций, которая увеличивает общее число молей. [34]
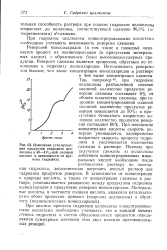 |
Изменение угла враще - глюкозы в растворе. Поэтому при ния продуктов гидролиза цел - ft - j r. [35] |
При анализе процесса гидролиза целлюлозы концентрированными кислотами необходимо учитывать, что в каждый момент степень гидролиза и состав образовавшихся продуктов определяются суммарным влиянием этих двух взаимно противоположных реакций. [36]
Принцип Ле Шателье иногда формулируется так: Если на систему, находящуюся в равновесии, производится Внешнее воздействие, то равновесие смещается в сторону той из двух противоположных реакций, которая ослабляет данное воздействие. Какое слово в данной формулировке лишнее. Укажите условия, которые должны обязательно находиться в формулировке. [37]
Принцип Ле Шателье иногда формулируется так: Если на систему, находящуюся в равновесии, производится внешнее воздействие, то равновесие смещается в сторону той из двух противоположных реакций, которая ослабляет данное воздействие. Какое слово в данной формулировке лишнее. Укажите условия, которые должны обязательно находиться в формулировке. [38]
Правая часть этого равенства представляет собой константу равновесия / ( с данной реакции и, следовательно, Кс к2 / кг представляет собой отношение констант скоростей двух противоположных реакций, составляющих данную обратимую реакцию. [39]
Принцип Ле Шателье: если изменить хотя бы одно из условий, определяющих состояние химического равновесия в данной системе, то в последней усиливается та из двух взаимно противоположных реакций, которая противодействует вносимому изменению, уменьшая его количественное выражение. При этом равновесие смещается в сторону, определяемую усилившейся реакцией. [40]
При химическом равновесии сколько молекул каждого из веществ ( А, В, С и D) исчезает в единицу времени, столько их и образуется в результате протекания противоположной реакции. Следовательно, по наступлении равновесия концентрации всех четырех веществ перестают изменяться. Нам кажется, что реакция остановилась. [41]
При наступлении химического равновесия в единицу времени столько молекул каждого из веществ А, В, С и D вступает в реакцию, сколько их образуется в результате протекания противоположной реакции. Следовательно, в состоянии равновесия концентрации всех реагирующих веществ перестают изменяться. Нам кажется, что реакция остановилась. [42]
Из рассмотренного вытекает, что химическое равновесие является равновесием динамическим: оно обусловлено не тем, что, дойдя до него, процесс прекращается, а тем, что обе взаимно противоположные реакции протекают с одинаковыми скоростями. Все время идет и образование молекул воды и их распад, но число образующихся за единицу времени молекул равно числу распадающихся. Поэтому нам и кажется, что изменений в системе не происходит. [43]
При достаточно большом времени, прошедшем после начала реакции акватации комплекса 1гС1з -, линейная зависимость р - t, описываемая уравнением (2.106), нарушается, что связано с влиянием противоположной реакции. [44]
При установившемся химическом равновесии столько же молекул каждого из веществ ( А, В, С и D) вступает в реакцию в единицу времени, сколько их образуется в результате течения противоположной реакции. Следовательно, при наступлении равновесия концентрации всех веществ в реакционной смеси перестают изменяться. При этом создается впечатление, что реакция как бы остановилась; фактически же обе реакции продолжают все время идти, но одна из них сводит на нет результаты другой. [45]
Страницы: 1 2 3