Значение - химический потенциал
Cтраница 1
Значение химического потенциала в теории растворов определяется двумя свойствами. [1]
Значение химического потенциала в теории растворов определяется следующими двумя важными свойствами этой функции. [2]
Значения химических потенциалов различных сортов частиц, по отношению к которым мембрана проницаема, в соответственных растворах определить довольно легко: их относительные химические потенциалы и молярные объемы те же самые, что и во внешних растворах. [3]
Поэтому значения химического потенциала ц и ц в соотношении ( Н-36) целесообразно рассматривать применительно к основному компоненту, для которого разность ц - № всегда меньше, чем для примесного компонента; эту разность о. [4]
Поэтому значения химического потенциала л и ц, в соотношении (11.55) целесообразно рассматривать применительно к основному компоненту, для которого разность ( ц-ц, ) всегда меньше, чем для примесного компонента. Эту разность обычно относят к паровой фазе, хотя в принципе она может быть отнесена и к жидкой фазе. [5]
Оцените значение химического потенциала 1 мг Не4, рассматривая его как идеальный ] газ, при 0 1 К. Сравните полученное значение с разностью между наинизшим и первым возбужденным уровнями, когда газ содержится в макроскопическом объеме. [6]
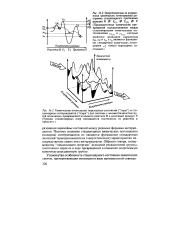 |
Энергетическая ( в координатах химических потенциалов диаграмма стационарного протекания. [7] |
Поэтому значения стационарных химических потенциалов ( напоров) интермедиатов не являются функциями стандартных значений термодинамичерких ( энергетических) характеристик непосредственно самих этих интермедиатов. Образно говоря, интермедиа накапливают энергию исходной реакционной группы, постепенно теряя ее в ходе превращений в наименее энергоемкую конечную реакционную группу. [8]
Однако значения химических потенциалов отдельных ионов, которые нужны для такого расчета, до сих пор с нужной точностью неизвестны. [9]
Разность значений химического потенциала компонента в двух частях системы можно вычислить, если обе части системы имеют одну и ту же температуру ( обязательное условие. [10]
Разность значений химического потенциала компонента в двух его состояниях при постоянной температуре равна ( с обратным знаком) изотермической нетто-работе обратимого химического процесса при пересчете на переход одного моля компонента из первого состояния во второе. Обратимую нетто-работу принципиально можно вычислить методами термодинамики. Читатели снова могут убедиться в термодинамической возможности вычислить разность двух значений химического потенциала при постоянной температуре. [11]
При равновесии значения химических потенциалов для каждого компонента в обеих фазах равны. В противном случае имеет место переход компонента из фазы с большим значением химического потенциала в фазу с меньшим его значением. [12]
Для получения значения химического потенциала компонентов требуется решить уравнение ( 4) во всем интервале давлений н температур, представляющих интерес. Аналогичным образом определяют другие интенсивные свойства фаз, как например, удельный объем п энтальпию. Исходные данные, на основании которых можно определять удельный объем, химический потенциал и энтальпию, могут быть представлены различными экспериментально определяемыми величинами ( см. таблицу. Чтобы определить перечисленные термодинамические величины в гомогенных системах, требуется некоторое минимальное количество экспериментальных данных. [13]
Для получения значения химического потенциала компонентов требуется решить уравнение ( 4) во всем интервале давлений и температур, представляющих интерес. Аналогичным образом определяют другие интенсивные свойства фаз, как например, удельный объем и энтальпию. Исходные данные, на основании которых можно определять удельный объем, химический потенциал и энтальпию, могут быть представлены различными экспериментально определяемыми величинами ( см. таблицу. Чтобы определить перечисленные термодинамические величины в гомогенных системах, требуется некоторое минимальное количество экспериментальных данных. [14]
Весь интервал доступных значений химического потенциала: - оо / / е 0 ( энергетическая шкала) в пределе Т - 0 распадается на последовательность суб-интервалов, в пределах каждого из которых только один член разложения по степеням активностей ( 20) является доминирующим. [15]
Страницы: 1 2 3 4