Коррозионная реакция
Cтраница 1
Коррозионные реакции обусловлены термодинамической неустойчивостью металла: последний стремится перейти в ионное состояние. [1]
Если коррозионная реакция может быть представлена диаграммой, приведенной на фиг. Если же ситуация подобна представленной на фиг. Катодным контролем, поскольку изменения анодной кривой будут мало сказываться на точке пересечения. [2]
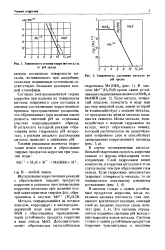 |
Зависимость степени коррозии металла от рН среды.| Зависимость состояния металла от рН среды. [3] |
Исследование коррозионных реакций с образованием твердых продуктов коррозии и успешное прогнозирование коррозии возможно при наличии полной характеристики твердых фаз, образующихся в системе Me2 Н201 В. [4]
В коррозионных реакциях принимает участие лишь часть кислорода, которая поступает в точку реакции, поэтому на поверхность металла растворенный кислород должен диффундировать через неподвижные слои жидкости, существующие на поверхности металла даже в текучей среде. Проникновение кислорода через этот диффузионный слой является наиболее медленным и поэтому определяющим скорость коррозии процессов. [5]
В результате электрохимические коррозионные реакции приводят к растворению металла. [6]
В большинстве коррозионных реакций металл покрывается пленкой, и активность ионов металла часто бывает меньше единицы, поэтому представленные в табл. 6 величины нельзя применять непосредственно. [7]
Из кинетики коррозионных реакций вытекает, что нельзя сравнивать коррозионную стойкость отдельных металлов и сплавов только по их месту в ряду напряжений. Решающим для их коррозионного поведения является ход и расположение поляризационной кривой, изображающей зависимость между электродным потенциалом и током, протекающим через границу электрод - электролит. На приведенной коррозионной диаграмме ( рис. 1, а) показана сумма отдельных катодных и анодных плотностей тока в виде поляризационной кривой, отвечающей поляризации электрода при прохождении внешнего тока. [8]
Если Свободная энергия коррозионной реакции имеет отрицательное значение, то это свидетельствует о том, что термодинамический процесс коррозии возможен. [9]
Случаи совпадения по характеру коррозионных реакций в условиях камеры и в естественных условиях даже по отношению к одному металлу приводят часто к неправильному выводу о том, что короткие испытания в камере с солевым обрызгиванием могут соответствовать длительным испытаниям в определенных естественных условиях. [10]
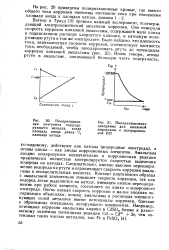 |
Поляризационная диаграмма корродирующего металла, когда площадь анода равна Y2 площади катода.| Поляризационная диаграмма для цинковой амальгамы в деаэрированной НС1. [11] |
Амальгама анодно поляризуется незначительно и коррозионная реакция практически полностью контролируется скоростью выделения водорода на катодах. Следовательно, именно высокое перенапряжение водорода на ртути и ограничивает скорость коррозии амальгамы в неокислительных кислотах. Контакт платинового образца с амальгамой значительно повышает скорость коррозии, так как водород легко выделяется на катоде, имеющем низкое перенапряжение при работе элемента, состоящего из цинка и водородного электрода. Очень низкая скорость коррозии и малая анодная поляризация объясняют, почему амальгамы в растворах соответствующих солей металлов имеют потенциалы коррозии, близкие к обратимому потенциалу легирующего компонента. [12]
Отрицательное значение ( уменьшение) свободной энергии коррозионной реакции соответствует термодинамической возможности протекания процесса коррозии. [14]
Значит, в зависимости от характера протекающей коррозионной реакции они могут находиться в различных группах коррозионной устойчивости. [15]
Страницы: 1 2 3 4
