Неразветвленная реакция
Cтраница 1
Неразветвленные реакции таким свойством не обладают и для них требуется непрерывное образование исходных радикалов в течение всего времени реакции. [1]
Если неразветвленная реакция продолжения цепи является при высоких температурах более быстрой, чем реакция разветвления, то это и приведет с ростом температуры к прохождению скорости реакции через максимум и исчезновению воспламенения. [2]
Примером неразветвленной реакции может служить бимолекулярная реакция Н2 С12 2НС1, которая имеет большую энергию активации ( Е 167700 Дж / моль) и в обычных условиях не может протекать в соответствии с приведенным уравнением. [3]
Скорость неразветвленной реакции может быть определена и другим путем, исходя из того, что она так же, как и скорость любой цепной реакции, практически совпадает со скоростью реакции продолжения цепи, поскольку по сравнению с последней скорость реакции зарождения цепи w0 ничтожна. [4]
Таким образом, в радикально-цепной неразветвленной реакции длина кинетической цепи ( v) при линейном обрыве цепи не зависит от скорости зарождения цепи и определяется отношением констант скорости продолжения и обрыва цепей. При квадратичном обрыве цепи длина кинетической цепи ( v) обратно пропорциональна корню квадратному из скорости зарождения цепи. [5]
Таким образом, торможение продуктом неразветвленной реакции может сильно замедлить реакцию из-за уменьшения v; при не слишком большом времени выдержки это торможение может быть ошибочно принято за предел реакции. [6]
Был доказан также гомогенно-гетерогенный характер инициирующей реакции и гомогенный характер второй стадии-цепной неразветвленной реакции образования конечного продукта, индуцированной распадом промежуточного вещества. [8]
Как видим, протекание стационарной разветвленной цепной реакции вполне сходно с протеканием неразветвленной реакции. Это не является неожиданным, так как следует и из чисто качественных соображений. Действительно, когда Р §, фактор разветвления будет только как бы ослаблять, но не сможет полностью ликвидировать действие фактора обрыва. [9]
Однако скорости реакций распространения цепей настолько превышают скорости реакций инициирования и обрыва цепей, что в течение основной стадии неразветвленных реакций члены в выражении для 3г, соответствующие реакциям распространения цепей, будут гораздо больше членов dcjdt для активных центров, и, следовательно, приближение, в котором щ 0 ( для активных центров), оказывается справедливым с высокой степенью точности. Полезной проверкой справедливости стационарного приближения является использование его в качестве нулевого приближения в итерационной схеме. Определив все концентрации с4 ( t) из стационарного приближения, находят далее величины dci / dt и, подставляя полученные значения в формулу ( 14), получают первое приближение для функций uj ( t), соответствующих активным центрам. Стационарное приближение является оправданным, если относительная разность между первым и нулевым приближениями для концентраций с-г ( t) оказывается малой по сравнению с единицей. К сожалению, алгебраические трудности часто не позволяют довести до конца даже эту первую итерацию, не прибегая к численным методам. Фактически мы уже пользовались стационарным приближением в пункте б § 3, при обсуждении механизма мономолекулярной реакции Линдемана. [10]
Для иеразветвленной цепной реакции, в которой зарождение и обрыв цепи происходят на стенке, использование, в качестве критерия для определения механизма, зависимости скорости реакции от диаметра не позволяет отличить эту реакцию отцепной разветвленной или неразветвленной реакции, в которой инициирование и обрыв цепи происходят в газовой фазе. В этом случае, однако, могут быть использованы другие критерии, в частности то, что скорость реакции, отнесенная к единице поверхности, и эффективность обрыва ценен на стенках зависят от природы поверхностей. Во всех других случаях разветвленных и неразветвленпых реакций в качестве критерия может быть использован диаметр сосуда. [11]
Различают неразветвленные и разветвленные цепные реакции. В случае неразветвленной реакции каждый активный центр при взаимодействии порождает один новый активный центр, дающий начало новой цепи. [12]
 |
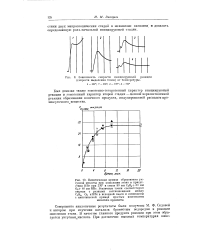
Увеличение давления во время реакции пентана с кислородом. [13] |
Последние наблюдения были сделаны над этаном и пропаном и касались главным образом зависимостей между диаметром сосуда и давлением, причем были обнаружены те же закономерности, что и для метана - Как и в случае метана, было отмечено существование критического диаметра сосуда, ниже которого реакция прекращалась. Точно так же можно-предположить, что период т2 представляет собой неразветвленные реакции цепные, инициируемые окислением формальдегида и, возможно, других альдегидов. Альдегиды, особенно формальдегид, всегда образуются в период т1 и этим оба периода связаны между собой, так же как и остатками перекисей. [14]
Первая часть сборника, содержащая 9 статей, посвящена элементарным реакциям. Во второй части ( 8 статей) рассматриваются механизмы и кинетические закономерности ряда цепных разветвленных и неразветвленных реакций. Наиболее краткие четвертая и пятая части содержат две и три статьи и посвящены важным ответвлениям химической кинетики - применению современных кинетических представлений к описанию некоторых биологических процессов и процессов горения. [15]
Страницы: 1 2