Цепная реакция - окисление
Cтраница 1
Цепные реакции окисления по-прежнему остаются интенсивно развивающейся областью научных и научно-технических исследований, имеющих огромную практическую важность. [1]
Цепная реакция окисления циклогексана начинается с зарождения в системе свободных радикалов. Первоначально считалось, что это может происходить вследствие гемолитической диссоциации одной из связей молекулы циклогексана. Так как, однако, прочность этих связей велика ( в циклогексане СН - 90 / скал; С - С - 76 ккал), то и энергия активации такого процесса будет слишком большой, чтобы могла получиться достаточная скорость зарождения. [2]
Цепные реакции окисления газов имеют нижний и верхний пределы давлений ( концентраций), выше и ниже которых эти реакции не идут или протекают медленно. [3]
Цепные реакции окисления газов имеют нижний и верхний пределы давлений ( концентраций), ниже и выше которых эти реакции не идут или протекают медленно. В границах же давлений от нижнего до верхнего пределов наблюдается воспламенение или взрыв. [4]
Почему цепная реакция окисления сульфита кислородом индуцирует окисление арсенита. Очевидно, арсенит-ион, получая удар от какой-нибудь частицы в ходе цепной реакции сульфид - кислород, становится активным и в таком виде легко окисляется. Цепной процесс повышает энергетический уровень арсенит-ионов. [5]
Развитие цепных реакций окисления связано с образованием перекисных радикалов RO2 Hx распадом, превращением в гидроперекиси ROOH. Гидроперекиси в свою очередь могут разлагаться с образованием свободных радикалов RO и ОН или же превращаться в более устойчивые кислородсодержащие соединения. [6]
Теория цепных реакций окисления ( Н. Н. Семенов) явилась научным фундаментом для разработки эффективных технологических процессов получения различных кислородсодержащих соединений: уксусной кислоты и метилэтилкетона окислением бутана; фенола и ацетона окислением кумола; пропиленоксида сопряженным окислением пропилена и уксусного альдегида; высших жирных спиртов и синтетических жирных кислот окислением я-парафинов; нитрила акриловой кислоты окислительным аммонолизом пропилена; оксидов, альдегидов и малеино-вого ангидрида окислением олефинов; формальдегида и метанола окислением метана; бутадиена окислительным дегидрированием бутенов и целого ряда других процессов. [7]
Особенностью цепной реакции окисления углеводородов является наличие периода индукции, указывающего на сложность процесса. В связи с этим химический процесс горения углеводородов протекает медленнее, чем горение водорода и окиси углерода. [8]
Так называются цепные реакции окисления молекулярным кислородом. Они развиваются в результате образования свободных радикалов за счет каких-либо инициаторов. [9]
Так, цепная реакция окисления углеводородов идет вначале с очень малой скоростью. В каждом звене такой элементарной цепи образуется перекись, которая, реагируя с кислородом, быстро распадается на конечные продукты НаО н СО. [10]
Майзус) Цепные реакции окисления углеводородов в жидкой фазе, в которой подведены итоги проводившихся с 1954 исследований: открыты новые инициаторы и стимуляторы цепных реакций ( в частности, металлоорганического характера); установлен механизм зарождения, разветвления, продолжения и обрыва цепей при окислении углеводородов; определена энергия активации элементарной стадии продолжения цени при окислении н-декалина, этилбензола, тетралина, сквалена; определены константы скорости вырожденного разветвления; разработаны способы управления процессом окисления углеводородов. [11]
Участвуя в цепной реакции окисления, спирт поставляет оксиперекисные радикалы, появление которых приводит к новым особенностям процесса. [13]
Как пример цепной реакции окисления, протекающей в водном растворе, они берут открытое Титовым ускорение окисью меди окисления молекулярным кислородом сернистой кислоты в щелочном растворе. Что мы здесь имеем дело с цепной реакцией, с полной ясностью доказал Бак - стром22, установивший, что такое же действие, как двувалентный ион меди, оказывает ультрафиолетовый свет, причем каждый поглощенный световой квант вводит в действие десятки тысяч молекул кислорода. [14]
 |
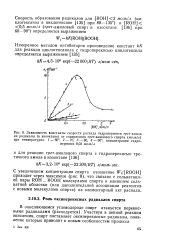
Кинетические кривые накопления метилэтилкетона при окислении сжиженного бутана при 135 под давлением ( по данным Н. М. Эмануэля. [15] |
Страницы: 1 2 3 4