Очень быстрая реакция
Cтраница 1
Очень быстрые реакции фактически проходят со скоростью, определяемой только скоростью диффузии - скоростью доставки частиц к пункту их соударения - и константы их скорости одного порядка с коэффициентами диффузии соответствующих веществ в растворах. К очень быстрым реакциям принадлежат такие, в которых не происходит изменение ковалентных связей. [1]
 |
Константы скоростей реакции передачи протона с участием Н3О при 25 С. [2] |
Очень быстрые реакции, в которых отсутствуют изменения ковалентных связей. В этих реакциях определяющим является электростатическое взаимодействие ионов. Скорость протекания такого типа реакций зависит главным образом от подвода реагирующих веществ друг к другу - перемешивания, конвекции, диффузии. [3]
Очень быстрые реакции могут проходить со скоростями, превышающими скорость перегруппировки. Например, при дегалогени-ровании соединения ( 12) с помощью гидрида трифенилолова ( см. разд. [4]
Очень быстрые реакции переноса протона, по-видимому, единственные, в которых удается обнаружить отклонение от классического поведения, а именно проявление квантовомеханического туннельного эффекта. Речь идет о конечной вероятности для частицы преодолеть энергетический барьер даже, если ее энергия меньше высоты барьера. Дело в том, что для протона длина волны де - Бройля X h / mv имеет наибольшее значение по сравнению с другими атомами. При обычных температурах она равна I-2 А и может оказаться одного порядка с шириной энергетического барьера. Предсказывают, например, следующее проявление туннельного эффекта в кинетике. Выше комнатной температуры график зависимости gk от 1 / Т будет приблизительно линеен в соответствии с уравнением Аррениуса. [5]
Это очень быстрая реакция, идущая до конца и дающая на выходе газ с 30 % - ной концентрацией сероводорода. При помощи метода Клауса из него извлекают чистую серу. [6]
Это очень быстрая реакция - настолько быстрая, что обратимость термонейтральной стадии не удается обнаружить. Много лет назад Лондон, Поляньи и Эйринг теоретически доказали, что переходное состояние гемолитических процессов замещения того класса реакций, к которым принадлежат реакции ( 2) и ( 3), должно быть линейным. [7]
Известны очень быстрые реакции ( преим. Нек-рые соли гидролизуются медленно ( напр. [8]
Известны очень быстрые реакции ( преим. Нек-рые солп гидролизуются медленно ( напр. [9]
Для очень быстрых реакций все перечисленные способы, к сожалению, оказываются бесполезными. [10]
Для очень быстрых реакций ( исследуемая реакция протекает быстрее, чем смешение. Установление нового равновесия наблюдается при помощи, например, измерений электропроводности или светопоглощения. Время, в течение которого произошло приближение к равновесному состоянию на долю, равную / 2, называют временем релаксации. По времени релаксации могут быть рассчитаны константы скорости прямой и обратной реакций. [11]
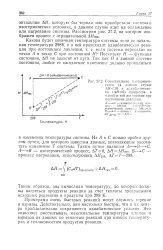 |
Сопоставление изотермического ( в данном случае Д / / 0 и адиабатического ( ДЯ 0 процессов в одной и той же системе при постоянном давлении. [12] |
Примерами очень быстрых реакций могут служить горение и взрывы. Действительно, они настолько быстры, что в их центре приблизительно сохраняются адиабатические условия. Это позволяет рассчитывать максимальные температуры пламен и взрывов из данных по теплотам реакций при низких температурах и теплоемкостям продуктов реакции. [13]
Другой очень быстрой реакцией явилось получение равновесной смеси метил-пентанов и 2 3-диметилбутана; наблюдаемая Еа в этом случае несколько выше ( 17 ккал / моль), что можно объяснить иным способом перегруппировки карбониевых ионов. Такие перегруппировки ( тип Б) сопровождаются изменением степени разветвления углеродной цепи. Как уже отмечалось ранее, перегруппировка третичного катиона в первичный потребовала бы более высокой энергии активации ( 30 ккал / моль), но для изомеризации с разветвлением углеродной цепи путем образования классических карбониевых ионов величина порядка 17 ккал / моль должна быть достаточной. [14]
Наконец, очень быстрые реакции должны иметь высокие значения А или низкие значения Е или и то и другое; очень медленные реакции имеют низкие значения А или высокие значения Е или и то и другое вместе. [15]
Страницы: 1 2 3 4