Каталитическая реакция - окисление
Cтраница 3
 |
Кривые LA ( 1, L ( 2 системы, . [31] |
С, Ким В. Ф. Об одной простой модели кинетических автоколебаний в каталитической реакции окисления СО / / Докл. [32]
Аналогичный эффект достигается при активировании серебра ( 1) в каталитической реакции окисления сульфани-ловой кислоты персульфатом. В отсутствие активатора медь ( 11) и железо ( 111) мешают определению, так как сами заметно катализируют реакцию, присутствуя в больших количествах, чем 0 6 и 10 мкг соответственно. [33]
В нескольких работах тяжелый изотоп кислорода был применен для изучения природы каталитических реакций окисления. [34]
Изучена избирательность и воспроизводимость кинетических методов определения Со, основанных на каталитических реакциях окисления ализаринового красного С и гайрона перекисью водорода. [35]
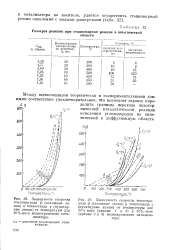
Между вычисленными теоретически и экспериментальными данными соответствие удовлетворительное, что позволяет заранее определить границы перехода экзотермической каталитической реакции окисления углеводородов из кинетической в диффузионную область. [37]
Отметим еще работу Ритчи и Кэльверта [122], которые обнаружили ускоряющее действие ультрафиолетового света на каталитическую реакцию окисления СО, протекающую на закиси меди. [38]
Отсюда однозначно вытекает, что образование ванадил-ванадатов ни в коей мере не может рассматриваться как этап каталитической реакции окисления двуокиси серы, а является побочным процессом, приводящим к необратимому снижению активности катализатора. [39]
Замена серы на кислород в этом случае приводит к значительному, более чем на 2 порядка, росту скорости каталитической реакции окисления. Здесь же показано и сильное влияние дальнего окружения: замена в цепи полимера органического радикала дифенила R3 на метилдифенил R. В таблице представлены результаты, характеризующие влияние замены азота на кислород хелатного узла - 2 ( N, О) Me на 2 ( О, О) Me в реакциях окисления кумола и разложения перекиси водорода. Для медных и никелевых полихелатов такая замена приводит к росту каталитической активности в реакциях окисления кумола и разложения перекиси водорода. Для полихелатов железа наблюдается обратное влияние. [40]
Мы рассматриваем эту проблему в общем виде в лекции на I Симпозиуме по кинетике сложных реакций [6], где показано, что огромное большинство каталитических реакций окисления протекает по механизму Марса - Ван Кр велена. [41]
Однако ряд преимуществ проточного метода ( простота конструктивного оформления, непрерывность работы, возможность проверки катализатора в условиях, близких к производственным) обеспечили ему широкое применение при изучении каталитических реакций окисления окиси углерода [21], сернистого ангидрида [22], аммиака [23], спиртов [24] и многих других. [42]
Методами электрофизических измерений, ИКС ФП, РФЭС, масс-спектрометрии и термогравиметрии показано, что чувствительность и обратимость микро-сенсоров на основе этих соединений к указанным газам, связана с протеканием на поверхности газочувствительного слоя каталитической реакции окисления хемосорбированных газов сорбированным на поверхности активных центров кислородом. [43]
Переходя к новым работам по кинетическим методам, следует отметить, что в работе [43] определяли 0 036 мкг Мо в 3 5 мл раствора с относительной ошибкой 2 % при автоматической спектрофотометрической регистрации скорости каталитической реакции окисления йодида перекисью водорода. [44]
 |
Принципиальная технологическая схема установки для производства водорода. I - сырье. II - водяной пар. III - водород. IV - двуокись углерода. V - вода. VI - водный раствор карбоната калия. [45] |
Страницы: 1 2 3 4