Электрохимическая реакция - окисление
Cтраница 1
Электрохимические реакции окисления или восстановления не требуют введения в раствор химических реагентов - здесь применяется самый универсальный химический реагент - электрический ток. [1]
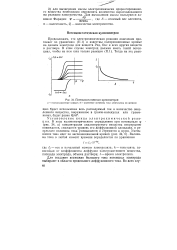 |
Потенциостатическая кулонометрия. [2] |
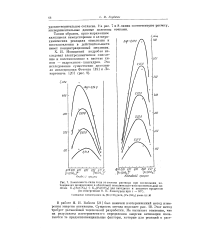
Предположим, что электрохимическая реакция окисления протекает по уравнению (II.1) и известны поляризационные кривые на данном электроде для веществ Ред, Оке и всех других веществ в растворе. [3]
Для уменьшения протекания электрохимических реакций окисления, рекомендуется обертывать аноды толстой, но рыхлой тканью типа фильтровального сукна. [4]
Дело в том, что электрохимическая реакция окисления аниона карбоновой кислоты протекает только на поверхности анода. Следовательно, вовсе не обязательно изготавливать весь анод из платины. При нанесении тонкого слоя платины на поверхность анода из недрагоценного металла последний приобретает все свойства сплошного платинового электрода. Таким образом, большая экономия драгоценного металла не влечет за собой снижения эффективности процесса электрохимического синтеза. [5]
Поляризация может вызываться и замедленной кинетикой электрохимической реакции окисления и восстановления. Как правило, при работе элемента падение напряжения вызывается рядом причин. [6]
В растворах для химической металлизации возможно протекание электрохимической реакции окисления восстановителя и восстановления ионов металла в объеме раствора. [7]
Приведенные примеры наглядно свидетельствуют о том, что электрохимические реакции окисления очень часто протекают с образованием димерных продуктов и являются удобным методом получения целого ряда бифункциональных соединений, находящих применение в производстве высокополимеров, пластификаторов, смазочных масел, душистых веществ. [8]
Таким образом, ярко выраженное кажущееся самоускорение в электрохимических реакциях окисления и восстановления в действительности имеет концентрационный механизм. [10]
Наибольший интерес представляет использование этой реакции в сочетании с электрохимическими реакциями окисления различных видов топлива для электрохимического процесса беспламенного холодного горения. Этот процесс лежит в основе работы так называемых топливных элементов, в которых химическая энергия топлива превращается в электрическую. [11]
При этом для упрощения принимается, что не происходят процессы электрохимических реакций окисления - восстановления каких-либо компонентов раствора. [12]
В первый момент прохождения тока на поверхности металла в результате электрохимической реакции окисления образуется очень тонкий оплошной слой. Слой образуется достаточно быстро. Но после достижения толщины 0 5 - 1 мк вследствие сильного торможения процесса взаимного проникновения реагирующих частиц дальнейшее образование пленки затрудняется и рост ее прекращается. [13]
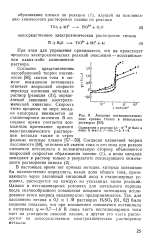 |
Анодные потенциостатиче-ские кривые титана в втанольных растворах. [14] |
При этом для упрощения принимается, что не происходят процессы электрохимических реакций окисления - восстановления каких-либо компонентов раствора. [15]
Страницы: 1 2 3 4