Электрохимическая реакция - окисление
Cтраница 2
Термодинамическая эффективность деполяризатора характеризуется величиной равновесного ( обратимого) потенциала соответствующей электрохимической реакции окисления - восстановления деполяризатора. Чем более положителен этот потенциал, тем, следовательно, выше способность деполяризатора отбирать электроны у электрода, осуществляя катодную реакцию в коррозионном процессе и вытесняя из нее катионы металла. [16]
Полученные в результате физико-химических измерений данные характеризуют главным образом особенности электрохимической реакции окисления аниона и не всегда позволяют сделать достаточно обоснованные выводы о направлении вторичных процессов, которые носят радикальный характер и приводят к образованию димерных продуктов. Это в особенности относится к реакциям электрохимической аддитивной димеризации, продуктами которой являются диэфиры высших ненасыщенных дикарбоновых кислот. [17]
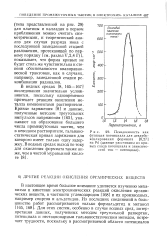 |
Псевдоемкость как функция потенциала для декарбо-ксилирования формиата на РА ( данные рассчитаны из кривых спада потенциала и зависимостей ток - потенциал. [18] |
В настоящее время большое внимание уделяется изучению механизма и кинетики электрохимических реакций окисления органических веществ, в частности углеводородов [168] и их производных, например спиртов и альдегидов. [19]
В ТЭ химическая энергия подаваемых в элемент реакционно-способных веществ в результате электрохимических реакций окисления вещества, служащего топливом, и восстановления вещества, являющегося окислителем, преобразуется в электрическую энергию; расходуемые активные элементы непрерывно подводятся извне и это обеспечивает непрерывную работу ТЭ. Принцип действия ТЭ следующий. В сосуде с электролитом помещаются два электрода - анод и катод. К поверхности анода непрерывно подводится восстановитель-топливо, а к поверхности катода - окислитель. Электрод, контактирующий с восстановителем-топливом, принимает более отрицательный потенциал по сравнению с электродом, находящимся в контакте с окислителем. При замыкании внешней цепи по ней потечет электрический ток, а на границах электрод-электролит будут происходить электрохимические реакции, приводящие к передаче электронов от электрода к электролиту или обратно. В электролите электрический ток возникает вследствие перемещения ионов от одного электрода к другому. [20]
 |
Прямая амперостатическая кулонометрия. Изменение кривых l f ( E при определении растворенных веществ. [21] |
Следовательно, при потенциале рабочего электрода Е можно количественно определить комплексен III, так как электрохимическая реакция окисления Hg при этом потенциале ограничивается скоростью переноса из раствора к электроду молекул комплексона III. Поэтому при полном связывании HgY в комплекс HgY ток в цепи стремится к нулю. На этом же принципе основано, например, определение С1 - - ионов на Ag-электроде. [22]
При выборе оптимальных условий электросинтеза пероксодвусерной кислоты и ее солей приходится учитывать не только протекание на аноде электрохимической реакции окисления аниона HSO4 -, но и поведение продуктов электролиза в объеме раствора. [23]
Кл; Р - масса вещества, выделившегося на электроде, г; и - число электронов, участвующих в электрохимической реакции окисления или восстановления; F - число Фарадея, равное 96487 Кл; М - молекулярная масса электропревращенного вещества. [24]
Напряжение разложения вещества при электролизе ( символ - U, единица - В) - напряжение, при котором на электродах электролизера начинаются электрохимические реакции окисления и восстановления. Напряжение разложения вещества представляет собой сумму всех видов поляризации обоих электродов в условиях начала электролиза. [25]
При разработке методов амперометрического титрования основной проблемой является нахождение условий, обеспечивающих одновременное протекание химической реакции между определяемым элементом и реагентом, а также электрохимической реакции окисления или восстановления реагента. [26]
Во всех описанных выше типах водородно-кислород-ных элементов применяется щелочной раствор электролита, что связано с тем, что активность никеля, угля по отношению к электрохимическим реакциям окисления и восстановления водорода и кислорода в щелочных растворах значительно выше, чем в нейтральных или кислых растворах. С другой стороны, применение щелочных растворов имеет тот недостаток, что при наличии примесей углекислого газа в водороде или кислороде раствор постепенно карбонизируется, что резко снижает характеристики элемента. [27]
На участке III потенциал достигает таких значений, что начинается разряд ионов хлора, адсорбция атомов хлора на электроде и практически весь ток расходуется на протекание электрохимической реакции окисления ионов хлора. [28]
На участке III потенциал достигает таких значений, что начинается разряд ионов хлора, адсорбция атомов хлора на электроде, и практически весь ток расходуется на протекание электрохимической реакции окисления ионов хлора. [30]
Страницы: 1 2 3 4
