Электрохимическая реакция - окисление
Cтраница 3
Несколько слов следует сказать о достоинствах электрохимического метода синтеза. Электрохимические реакции окисления или восстановления пе требуют введения в раствор химических реагентов - здесь применяется самый универсальный химическш реагент - электрон. На поверхности электрода электроны отни маются или присоединяются к молекулам. Преимущество электр ( химического метода определяется не только отсутствием в реашд онной смеси химических окислителей или восстановителей, но v тем, что реакции можно проводить при нпзкой температуре, когд. [31]
Во время электродных реакций, вызываемых электрическим током, электроны на аноде освобождаются, а на катоде связываются. Вследствие этого на аноде происходят электрохимические реакции окисления, а на катоде - восстановления. [32]
Стеклянный электрод относится к мембранным электродам, механизм действия которых все еще не вполне установлен, однако имеется немало состоятельных объяснений причин функционирования стеклянных электродов в качестве водородных электродов. И хотя в данном случае отсутствуют электрохимические реакции окисления и восстановления компонентов, обусловливающие возникновение разности потенциала на поверхности раздела стекло - раствор, зависимость потенциалов стеклянных электродов от рН растворов вполне закономерно описывается уравнением, аналогичным уравнению Нернста. [33]
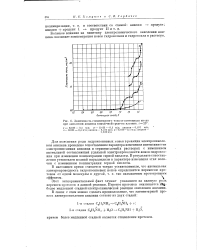 |
Зависимость стационарного тока от потев циала анода при окислении анилина в щелочной среде на платине, t 25. [34] |
Этот экспериментальный факт служит указанием на важную роль переноса протонов в данной реакции. Перенос протонов оказывается Ци-более медленной стадией электрохимической реакции окисления анилина. [35]
В работах [48, 58] продемонстрирована принципиальная возможность создания пористых газодиффузионных ферментативных электродов. Как известно, угольные электроды инертны в электрохимической реакции окисления водорода. Процесс ионизации водорода на угольных электродах протекает с большим перенапряжением. Исследование системы водород - гидрогеназа - медиатор - угольный электрод показало, что в этой системе удается осуществить окисление молекулярного водорода в условиях, близких к равновесным. [36]
Исходя из этого, порядок величины плотности тока обмена / о электрохимической реакции окисления поверхности получается равным io - 150 ма / см. Для поляризации г 142 мв это соответствует приблизительно максимуму отклонения. [37]
Исходя из этого, порядок величины плотности тока обмена / 0 электрохимической реакции окисления поверхности получается равным / g - 150 ма / см. Для поляризации г 142 мв это соответствует приблизительно максимуму отклонения. [38]
При использовании в качестве топлива не водорода, а окиси углерода характеристики элемента несколько ухудшаются. В этом случае наряду с сопротивлением появляется поляризация электрода, обусловленная замедленностью электрохимической реакции окисления топлива. Скорость реакции зависит от каталитических свойств электродного материала. [39]
В кулонометрии при контролируемом потенциале реакция, на которой основано определение вещества, проводится на рабочем электроде, потенциал которого поддерживается постоянным. Для выполнения измерений используют три электрода: рабочий электрод, на котором протекает электрохимическая реакция окисления или восстановления определяемого вещества; вспомогательный электрод и электрод сравнения для измерения потенциала рабочего электрода. [40]
Реагентами этих реакций являются катионы и анионы органолюминофоров, образующиеся на поверхности электрода во время электрохимических реакций окисления и восстановления. При этом кванты ЭХЛ возникают в результате излучательной дезактивации электрон-возбужденных молекул органолюминофора - продуктов экзотермических реакций переноса электрона от анион-радикала к катион-радикалу органолюминофора. [41]
Стабилизация процесса фильтрации электролита в условиях электролиза является важной задачей при изготовлении полимерной фильтрующей диафрагмы. Раствор хлорной кислоты, насыщенный хлором, подается в анодное пространство, где на аноде происходит электрохимическая реакция окисления хлора. Такое направление раствора в электролизере необходимо для предотвращения обеднения катодного пространства хлорной кислотой вследствие переноса ионов СЮ4 - в электрическом поле в анодное пространство. [42]
Это свидетельствует о том, что направление вторичных химических реакций определяется природой промежуточных радикалов, возникающих на аноде в результате электрохимической реакции окисления. [43]
Так, хорошие противоокислительные свойства показали наполнители - сера и MoS2 - доноры электронов. Наполнители ( сажа, графит, окись меди) - акцепторы электронов - значительно усилили окисление масла, очевидно, за счет анодной поверхностной электрохимической реакции окисления. [44]
 |
Основные типы отечественных кулонометрических газоанализаторов. [45] |
Страницы: 1 2 3 4