Многостадийная реакция
Cтраница 2
Поликонденсация является многостадийной реакцией, каждая стадия которой является элементарной реакцией взаимодействия функциональных трупа. Флори показал, что кинетика полиэтерификации аналогична кинетике этерификации монофункциональных соединений. Константа равновесия реакции образования полиэтилентерефталата равна 4 9 ( три 280е) вне зависимости от молекулярного веса полимера. Принцип независимости свойств связей и трупа в макромолекулах одного полимергомологического ряда от молекулярного веса полимера лежит в основе современной химии высокомолекулярных соединений. [16]
Поликонденсация является многостадийной реакцией. Каждая стадия представляет элементарную реакцию взаимодействия функциональных групп с постоянной константой равновесия / С на всех стадиях поликонденсации. [17]
При изучении механизма многостадийных реакций одна из проблем состоит в выявлении той стадии, на которой осуществляется общий катализ. [18]
Для описания таких многостадийных реакций целесосбразнее воспользоваться понятием скорость стадии сложной реакции, определяемая как скорость образования реагента в элементарной стадии, отнесенная к его стехиометрическому коэффициенту в химическом превращении на указанной стадии. Стехиометрическэму коэффициенту присваивается знак () или ( -) в зависимости от того, образуется или расходуется этот реагент на данной элементарной стадии реакции. [19]
Вейсс [4] определяет нетривиальную многостадийную реакцию как реакцию, при которой степень превращения реагентов превышает произведение степеней превращения, достигаемых в отдельных последовательных стадиях, протекающих через образование промежуточного газообразного компонента. Такие реакции противопоставляются тривиальной многостадийной реакции, где степень превращения реагентов в одну отдельную стадию аналогична наблюдаемой при проведении этой реакции в две отдельные последовательные стадии. [20]
Описание интермедиатов в многостадийных реакциях является основной целью исследования их механизмов; если достаточно хорощо понята природа каждого интермедиата в реакции, то механизм реакции можно считать б значительной мере проясненным. Количество интермедиата, присутствующего в реагирующей системе в любой момент времени, зависит от скорости стадии, в которой он образуется, и от скорости его последующего превращения. [21]
Таким образом, из многостадийных реакций при повышении давления ускоряются лишь те, для которых наиболее медленная стадия ( определяющая скорость всего процесса) идет путем взаимодействия двух или большего числа молекул или радикалов, в результате которого число молекул уменьшается. [22]
Промежуточным продуктом в этой многостадийной реакции является салициловая кислота. С помощью меченых атомов установлено, что гидроксил оказывается у атома углерода, находящегося в о / шо-положении к атому углерода, связанному в исходной бензойной кислоте с карбоксилом. [23]
В двух - или многостадийной реакции с активной промежуточной частицей за медленной скоростьопре-деляющей стадией следует быстрая стадия, определяющая природу продукта. Таким образом стадии определяющие скорость и продукт реакции, отделены друг от друга. Если стадия, определяющая продукт, является бимолекулярной, то реагент-ловушка, вступающий в реакцию позже скоростьопределяющей стадии, не входит в уравнение скорости. Отсюда возникает различие между уравнением скорости и стехиометри-ческим уравнением, что в свою очередь позволяет сделать вывод о многостадийное реакции и участии активной промежуточной частицы ( ср. [24]
При этом в случае многостадийных реакций следует рассматривать только линейно независимые стадии, иначе система уравнений окажется избыточной, что может привести, например, к вырождению матрицы коэффициентов. [25]
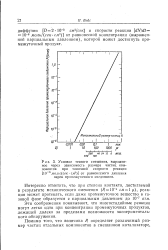 |
Условие тесного смешения, выраженное через зависимость размера частиц компонентов при типичной скорости реакции [ 0 - 6 моль / ( сек см3 от равновесного давления паров промежуточного соединения. [26] |
Эти соображения показывают, что многостадийные реакции могут легко идти при концентрации промежуточных продуктов, лежащей далеко за пределами возможности экспериментального обнаружения. [27]
То же относится к случаям многостадийных реакций. [28]
В подавляющем большинстве случаев механизм многостадийной реакции неизвестен. Поэтому составляют вероятную схему протекания реакции по стадиям. По этой схеме получают общее кинетическое уравнение суммарной реакции. [29]
То же относится к случаям многостадийных реакций. [30]
Страницы: 1 2 3