Очень медленная реакция
Cтраница 1
Очень медленная реакция может быть реакцией сильно удерживаемой р2 - формы с атомарным дейтерием, расположенным ниже уровня поверхности, что делает необходимым миграцию хемосорбированного водорода для взаимодействия с дейтерием или его вытеснения. Мы уже отмечали, что при не очень высоких температурах орто - пара-конверсия идет с большей скоростью, чем реакция дейтеро-водород-ного обмена; следовательно, в отсутствие парамагнитной реакции диссоциация и испарение дейтерия не могут быть лимитирующими скорость процесса стадиями. Добавляя к реакционной системе адсорбирующиеся яды, вступающие в обмен с дейтерием, и сравнивая относительные скорости орто - пара-конверсии и реакции дейтерообмена, можно выявить стадии, определяющие скорость реакции. [1]
Например, очень медленные реакции кро-тоновой и изокротоновой кислот с надбензойной кислотой в хлороформе заканчиваются лишь через три месяца [10], в то время как пропилен легко вступает в эту реакцию. [2]
В случае очень медленной реакции ( рис. Х-19, a) S ss 1 и процесс протекает со скоростью, характерной для физической абсорбции. [3]
Очень быстрые и очень медленные реакции в химико-аналитических целях являются малопригодными. Хотя трудно установить какие-либо жесткие правила или критерии, ограничивающие применение тех или иных реакций в кинетических методах анализа, все же некоторые пределы применимости можно отметить. [4]
В небольшой степени идет очень медленная реакция образования доломита MgCO3 - СаСО3, которую Н. С. Курнаков и С. Ф. Жемчужный считали основной в процессах метаморфизации рассолов морского типа. [5]
Рассмотрим случаи очень быстрой и очень медленной реакции. [6]
Легко показать, что в случае очень медленных реакций раствор насыщается газом в течение времени, слишком малого для того, чтобы заментое количество растворенного газа успело вступить в реакцию. [7]
Скорость химического процесса ( для не очень медленных реакций) определяется, при прочих равных условиях, концентрацией реагентов и эффективностью их смешивания. В этом отношении из трех фазовых состояний веществ газообразного, жидкого и твердого наиболее благоприятные условия для протекания химических реакций создаются в жидкой фазе ( в. В газовой фазе скорость реакции невелика, вследствие малой концентрации реагентов, в твердой фазе - вследствие плохого смешивания, слишком медленной диффузии частиц. Надо добавить, что в жидкой фазе роль высокой концентрации реагентов не ограничивается количественным влиянием на скорость реакции. [8]
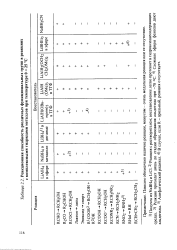 |
Реакционная способность различных функциональных групп в реакциях с комплексными гидридами металлов при температуре 0 - т - 25 С. [9] |
Плюсом обозначено наличие реакции, минусом - очень медленная реакция или ее отсутствие. [10]
Эти полимеры вырастают из зародышей, образующихся при очень медленной реакции, по-видимому, под влиянием молекулярного кислорода, причем сначала образуются полимерные перекиси. Активные зародыши, имеющие форму зерна, могут вызвать дальнейший рост не только диенов, но и моно-винильных соединений; при этом получаются совершенно нерастворимые, но еще набухающие продукты. [11]
Возможны и такие случаи химического растворения, сопровождающиеся очень медленной реакцией на поверхности кристалла, когда скорость растворения постоянна и зависит только от энергии кристаллической решетки, а также и случаи с более сложными кинетическими закономерностями, чем приведенные выше. [12]
Если мономер плохо растворим в жидкой фазе, то даже при очень медленной реакции образование полимера будет протекать на границе раздела жидкость - газ. Примером может служить газофазная поликонденсация с участием тиофосгена. [13]
В последнем случае важно, чтобы предельный ток, из-за не очень медленной реакции не был бы завышен в результате смещения исследуемого равновесия у поверхности электрода ( подробнее см. гл. [14]
Приведенное выше уравнение ( VI, 2) применимо и для расчета очень медленных реакций. [15]
Страницы: 1 2 3 4