Любая химическая реакция
Cтраница 4
Скорость любой химической реакции зависит от числа столкновений реагирующих молекул, но если бы все столкновения сопровождались взаимодействием, то реакции протекали бы в очень короткие отрезки времени. [46]
Для любой химической реакции, протекающей в изолированной системе самопроизвольно и необратимо, энтропия продуктов реакции всегда больше энтропии исходных веществ. [47]
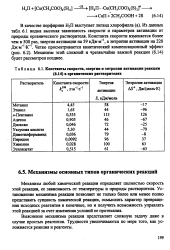 |
Константы скорости, энергии и энтропии активации реакции в органических растворителях. [48] |
Механизм любой химической реакции определяет полностью скорость этой реакции, ее зависимость от температуры и природы растворителя. Установление механизма реакции позволяет не только более или менее полно представить сущность химической реакции, осмыслить характер превращения исходных реагентов в конечные, но и получить возможность управлять этой реакцией за счет изменения условий ее протекания. [49]
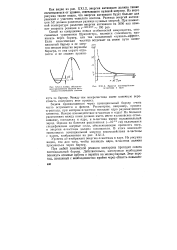 |
Схема, объясняющая зависимость энергии активации от изотопного состава.| Энергия взаимодействия а-частицы и ядра. [50] |
При любой химической реакции электроны проходят сквозь потенциальный барьер. Действительно, электронам необходимо покинуть атомные орбиты и перейти на молекулярные. [51]
Скорость любой химической реакции, зависящая от энергии активации и температуры, согласно известному уравнению Арре-ниуса, связана также с изменением энтальпии и энтропии исходных молекул при переходе их в состояние активного комплекса. Показана связь [34] между химическим и электрохимическим потенциалами системы и механическим воздействием на нее - локальным давлением. Последнее приводит к возрастанию химического я электрохимического потенциала вещества и значительному росту механо-химичеокой активности из-за локализации механо-химических эффектов в зоне фактического контакта трущихся поверхностей. Локальные давления в огромной Степени ( в не меньшей, чем температура) влияют на поверхностные химические и электрохимические реакции и хемосорбцию. [52]
Скорость любой химической реакции зависит от числа столкновений реагирующих молекул в единицу времени, но если бы все столкновения сопровождались взаимодействием, то реакции протекали бы в очень короткие отрезки времени. [53]
Скорость любой химической реакции зависит от числа столкновений реагирующих молекул, т.к. число столкновений пропорционально концентрациям реагирующих веществ. Однако не все столкновения молекул сопровождаются взаимодействием. Скорость реакции зависит не только от числа столкновений, но и от каких-то свойств сталкивающихся молекул. Это явление находит объяснение в теории активации Арре-ниуса. Согласно этой теории реакционноспособны только те молекулы, которые обладают запасом энергии, необходимым для осуществления той или иной реакции, т.е. избыточной по сравнению со средней величиной энергии молекулы. Эта избыточная энергия активной молекулы, благодаря которой становится возможна химическая реакция, носит название энергии активации. [54]
В любой химической реакции происходит разрыв одних и образование других химических связей. [55]
При любой химической реакции электроны проходят сквозь потенциальный барьер. Действительно, электронам необходимо покинуть атомные орбиты и перейти на молекулярные. Этот переход, связанный с необходимостью пройти через область повышенной энергии ( отрыв от атома), осуществляется как туннель-эффект. [56]
Страницы: 1 2 3 4