Любая химическая реакция
Cтраница 3
Любую химическую реакцию можно интерпретировать как взаимное превращение двух изомерных ансамблей молекул: правой и левой части уравнения реакции соответствуют изомерные ансамбли, принадлежащие к одному множеству. [31]
Любую химическую реакцию можно представить в виде химического уравнения, которое состоит из двух частей, соединенных знаком равенства. В левой части уравнения записываются формулы веществ, вступающих в реакцию, а в правой - веществ, полученных в результате реакции. [32]
Любую химическую реакцию можно представить как превращение одних веществ в другие, в любой реакции можно различить исходные реагенты и продукты реакции. Расход исходных веществ и получение продуктов реакции - это процесс, который происходит во времени. Правда, не всегда это время поддается измерению - некоторые химические реакции происходят практически мгновенно, тогда как для протекания других реакций необходимы годы. Как и любой процесс, проходящий во времени, химическая реакция характеризуется скоростью, под которой подразумевается скорость расходования исходных веществ или же скорость образования продуктов реакции. Более строго: скорость химической реакции - это изменение количества превращающегося вещества в единице объема в единицу времени, иначе говоря, изменение концентрации превращающегося вещества в единицу времени. Скорость реакции обычно измеряют по уменьшению концентрации начальных или по увеличению концентрации конечных веществ. [33]
Любую химическую реакцию можно описать матрицей стехио метрических коэффициентов [ N ], число строк которой равно числу реагентов, участвующих в реакции, а число столбцов равно числу стадий реакции. Элемент NHJ матрицы при этом определяется как стехиометрический коэффициент fe-ro реагента на / - и стадии, причем этому коэффициенту приписывается знак минус, если / с-й реагент является исходным, и знак плюс, если он образуется на данной стадии. [34]
Ход любой химической реакции может быть описан как движение точечной массы по поверхности потенциальной энергии, построенной ( обычно в многомерном пространстве) путем нанесения значений потенциальной энергии в соответствующих координатах, необходимых для полного описания системы. Когда такие поверхности построены с использованием обычных квантовомеханических методов, то в отдельных местах они образуют пересечения друг с другом. Строго говоря, при точных расчетах поверхности никогда не пересекаются, поскольку имеет место резонансное расталкивание. Два предельных случая такого расталкивания у точки пересечения показаны схематически на рис. 1 и 2, где представлены поперечные сечения поверхностей. На рис. 1 изображены две поверхности, соответствующие частицам одинакового типа, которые характеризуются одними и теми же величинами квантовых чисел Л и S и одинаковой симметрией. [35]
 |
Движение жидкости при работе турбинной мешалки. [36] |
Скорость любой химической реакции с повышением температуры увеличивается. Часто изменение температуры сказывается и на самом характере протекающей реакции. [37]
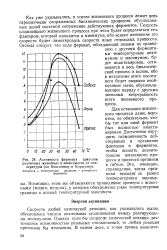 |
Активность фермента трипсина различных животных в зависимости от температуры ( по Коштоянцу и Коржуеву. [38] |
Скорость любой химической реакции, как указывалось выше, обусловлена числом возможных столкновений между реагирующими молекулами. [39]
Скорость любой химической реакции связана с числом столкновений реагирующих молекул, однако, подсчеты показывают, что если бы все столкновения молекул реагирующих веществ вызывали реакции, то последние бы протекали со сверхвзрывной скоростью. [40]
Интенсивность любой химической реакции принято характеризовать количеством вещества, вступившего в реакцию в единицу времени, в единице объема. Для газов и растворов, в которых чаще всего наблюдаются фотохимические реакции, количество вещества в единице объема измеряется его концентрацией. [41]
Скорость любой химической реакции зависит от числа столкновений реагирующих молекул, так как число столкновений ] пропорционально концентрации реагирующих веществ. Однако не все столкновения молекул сопровождаются взаимодействием. Очевидно, скорость реакции зависит не только от числа столкновений, но и от каких-то свойств сталкивающихся молекул. [42]
Скорость любой химической реакции с повышением температуры увеличивается, а иногда изменение температуры сказывается и на самом характере протекающей реакции. Поэтому в тех случаях, когда скорость химической реакции при обычной температуре мала, реагирующую смесь нагревают, а в тех случаях, когда хотят замедлить течение какой-либо реакции, прибегают к охлаждению. Кроме того, целый ряд вспомогательных процессов требует подогрева или охлаждения. [43]
Скорость любой химической реакции зависит от концентрации реагирующих веществ и от температуры. [44]
В любой химической реакции происходит разрыв одних и образование других химических связей. [45]
Страницы: 1 2 3 4