Быстрая химическая реакция
Cтраница 2
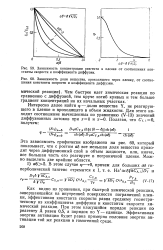
По признаку различного влияния быстрых химических реакций на полярографический ток выделяют два класса токов: кинетические и каталитические токи. Токи, контролируемые химическими реакциями, не приводящими к регенерации на электроде реагирующих, частиц, называют кинетическими. Токи, обусловленные электродными химическими реакциями, приводящими совместно с электрохимической стадией к регенерации хотя бы одной из реагирующих частиц ( катализатора), называют каталитическими. Ясно, что каталитические токи - лишь частный случай более общих кинетических токов, зависящих от скорости электродных химических реакций. [16]
При абсорбции, сопровождающейся быстрой химической реакцией, расстояние, которое поглощаемый газ должен пройти в жидкой фазе, обычно меньше, чем при физической или медленной реакции, и, следовательно, суммарная скорость массопередачи увеличивается. Расстояние, которое должен пройти поглощаемый газ, зависит от доступности реагента, которая является функцией концентрации и скорости диффузии реагента в растворителе. [17]
В общем случае при наличии быстрой химической реакции в жидкой фазе имеют место следующие механизмы абсорбции, соответствующие трем зонам по высоте колонны. [18]
Ранее видели, что воздействие быстрой химической реакции, протекающей на границе между газом и жидкостью, сводится к увеличению скорости абсорбции реакционноспособного газа. Как отмечали в разделе 8.11, при образовании с помощью растворенных молекул А нелетучего продукта реакции В в результате обратимого химического взаимодействия молекулы А и В могут диффундировать через жидкость вместе. Если реакция проходит с большой скоростью, то следствием будет повышение скорости ухода молекул А на величину коэффициента взаимодействия 0 1 / С. Аналогичным образом, если молекулы диоксида углерода, растворяющиеся в водном буферном растворе, могут при протекании обратимой реакции претерпевать взаимодействие с образованием HCOJ - нелетучей формы СО2 - то можно считать, что в растворе бикарбонатный ион выступает в роли носителя в отношении диоксида углерода. Если его равновесная концентрация велика, как в растворах с высоким значением рН, то большое различие в концентрациях на обеих сторонах пленки жидкости может приводить к возникновению большой диффузионной движущей силы, действующей поперек пленки. Эта картина может наблюдаться даже при небольших концентрациях растворенного СО2 во всех точках пленки. [19]
 |
Схема реализации эффекта клетки. [20] |
Взаимодействие свободнорадикальных частиц относится к быстрым химическим реакциям. [21]
Предположим, что на поверхности происходит быстрая химическая реакция, так что концентрация реагирующего вещества на пластинке равна нулю. [22]
Для наблюдения за процессом перемешивания использовалась быстрая химическая реакция рекомбинации атомарного кислорода, коэффициент скорости которой сильно зависит от температуры. Полученные в эксперименте результаты позволили проверить ряд расчетных моделей процесса турбулентного перемешивания с химическими реакциями в следе, кратко рассмотренных выше: ( а) модель ННК [70]; ( б) модель ГП [70]; ( в) бимодальное приближение [74]; ( г) модель ( ЗП) [73] и ( д) модель, в которой предполагалось, что профиль сред-пен температуры в следе является гауссовым с наложенными на него пульсациями. Оказалось, что наилучшее согласие экспериментальных и расчетных данных имеет место при использовании в расчетах бимодального приближения [74] с обязательным учетом пульсаций параметров следа. Таким образом, лишний раз было показано, что подходы. [23]
Как видно из уравнения, при быстрой химической реакции, завершающейся на внутренней поверхности пограничной пленки, эффективная константа скорости равна среднему геометрическому из коэффициента диффузии и константы скорости химической реакции. При этом кажущийся порядок реакции по реагенту А равен 0 5, а порядок по Y - единице. Эффективная энергия активации будет равна примерно половине энергии активации той же реакции в гомогенной среде. [25]
Релаксационные методы, используемые для исследования быстрых химических реакций в растворе, имеют весьма высокую разрешающую способность. Именно поэтому релаксационная кинетика широко используется при исследовании механизмов ферментативных реакций. [26]
Проводят опыты по абсорбции, сопровождаемой быстрой химической реакцией в жидкой фазе ( например, по абсорбции NH3 серной кислотой) при БВкр; при этом РР / СР ( стр. [27]
Но данный электродный процесс осложняется конкурирующей быстрой химической реакцией радикалов, а также адсорбцией компонентов реакции. [29]
 |
Распределение концентрации реагентов реакции г Вж Кж. в пограничных. [30] |
Страницы: 1 2 3 4 5