Обратимая химическая реакция
Cтраница 3
По мере развития обратимой химической реакции за счет возрастания скорости обратных процессов общая скорость реакции снижается и в конце концов достигается равновесное состояние, когда скорости прямой и обратной реакций сравниваются. Поэтому определенное количество сырья всегда остается неизменным. Практически равновесие достигается очень быстро. Истинное же равновесие достигается при времени реакции, равном бесконечности, когда разность скоростей прямой и обратной реакций асимптотически приближается к нулю. [31]
Итак, для обратимых химических реакций необходимо учитывать скорость как прямых, так и обратных реакций. Константа химического равновесия равна отношению констант скоростей прямой и обратной реакций. [32]
Когда в процессе обратимой химической реакции общее число молекул не меняется, изменение давления не влияет на состояние химического равновесия системы. [33]
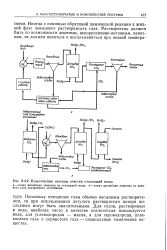 |
Комплексные системы очистки отходящей воды. [34] |
Иногда с помощью обратимой химической реакции в жидкой фазе повышают растворимость газа. [35]
Массообмен, осложненный обратимыми химическими реакциями. [36]
 |
Схема башенного способа непрерывного произ. [37] |
Ионный обмен является обратимой химической реакцией, которая происходит между замещенными ионами различных нерастворимых твердых веществ и ионами раствора. [38]
Гидролиз хлора является обратимой химической реакцией самоокисления - самовосстановления, при которой один из атомов хлора присоединяет электрон от другого атома и восстанавливается. [39]
Мы рассматривали простейший тип обратимой химической реакции, уравнение которой ( А В С D) содержит стехиометри-ческие коэффициенты, равные единице. [40]
Так, в случае обратимых химических реакций приповерхностные концентрации веществ будут близки к равновесным, наблюдаемая же скорость реакции определяется скоростью диффузии одного из реагентов. [41]
Для процессов, сопровождаемых обратимой химической реакцией между твердыми и газообразными реагентами, равновесные концентрации и равновесный выход продукта определяются при помощи константы равновесия, рассчитанной по концентрациям или парциальным давлением газообразных реагентов и газообразных продуктов реакции. При расчете константу равновесия выражают только через равновесные концентрации компонентов газовой фазы, поскольку парциальные давления насыщенных паров твердых веществ малы и почти не изменяются. Если реакция идет без изменения числа молей газа, равновесие зависит только от температуры. [42]
Для процессов, сопровождаемых обратимой химической реакцией между твердыми и газообразными реагентами, равновесные концентрации и равновесный выход продукта определяются при помощи константы равновесия, рассчитанной по концентрациям или парциальным упругостям газообразных реагентов и газообразных продуктов реакции. При расчете константу равновесия выражают только через равновесные концентрации компонентов газовой фазы, поскольку значения упругости насыщенных паров твердых веществ малы и почти не изменяются. [43]
Если помимо работы типа PV обратимая химическая реакция может сопровождаться выполнением какого-либо иного вида работы, например электрической, то изменение свободной энергии в ходе такой реакции отлично от нуля. Свободная энергия химической системы в ходе такой обратимой реакции уменьшается на величину, эквивалентную работе, выполненной системой над ее окружением: AG - ивнеш. [44]
Выше мы рассматривали простейший тип обратимой химической реакции, уравнение которой ( А - - В С - j - D) содержит стехиометричеекие коэффициенты, равные единице. Вообще же в выражении константы равновесия указанные коэффициенты являются показателями степеней при концентрациях соответствующих веществ [ см. выражение для скорости химической реакции, стр. [45]
Страницы: 1 2 3 4