Медленная химическая реакция
Cтраница 1
Медленная химическая реакция Аж Yr - - Продукты имеет порядок 0 5 по реагенту Y и нулевой по А. Выведите уравнение для определения концентрации Y в объеме жидкой фазы и для скорости процесса, если он осуществляется в переходной области и реакцией в пограничной пленке можно пренебречь. [1]
Медленная химическая реакция в растворе, предшествующая переносу электрона и приводящая к синтезу частиц, способных разряжаться на электроде, нередко ведет к появлению на поляризационной кривой кинетического предельного тока. Классическим примером такого процесса служит исследованная В. [2]
Медленная химическая реакция АЖ УГ - - Продукты имеет порядок 0 5 по реагенту Y и нулевой по А. Выведите уравнение для определения концентрации Y в объеме жидкой фазы и для скорости процесса, если процесс осуществляется в переходной области и реакцией в пограничной пленке можно пренебречь. [3]
При медленной химической реакции ( k t мало, Я, 1) равновесное распределение концентрации вещества А не нарушено, ток определяется константой скорости предшествующей химической реакции и является кинетическим током. [4]
Благодаря медленной химической реакции восстановления металла выделяется свободный металл ( например, Ag), осаждающийся на поверхности стекла. Наружный зеркальный слой покрывается дополнительно ( гальваническим путем) защитным слоем меди или же слоем лака. [5]
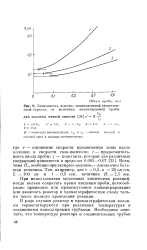 |
Зависимость высоты, эквивалентной теоретической тарелке, от величины анализируемой пробы. [6] |
При использовании медленных химических реакций, когда нельзя сократить время введения пробы, целесообразно применять или промежуточное концентрирование или включать реактор в хроматографическую схему только после полного проведения реакции. [7]
Кинетика процесса медленной химической реакции широко описана в литературе [6], поэтому нет необходимости останавливаться на этом вопросе. Следует только отметить, что количество продуктов, полученных в результате реакции третьего порядка, в общем балансе массопередачи, как правило, невелико. Поэтому процесс должен описываться уравнениями кинетики реакций второго порядка. [8]
Для проведения медленных химических реакций ( в случае использования абсорберов в качестве реакционных аппаратов) расчет движущей силы абсорбции и вообще расчет абсорбера как такового не нужны. [9]
В случае очень медленных химических реакций преобладает химическое сопротивление. Такой режим называют химическим. Для быстрых химических реакций скорость процесса может определять диффузионное сопротивление. Во многих эндотермических реакциях скорость процесса определяется скоростью теплопередачи, которая, в свою очередь, связана с гидродинамикой системы. [10]
Таким образом, очень медленная химическая реакция не влияет на коэффициент массопередачи, и в этом случае процесс описывается уравнениями, выведенными в предыдущем разделе для условия, что реакция в пограничной пленке отсутствует. [11]
Однако в случае медленных химических реакций время пребывания исходных веществ в реакторе значительно превышает продолжительность операций загрузки и выгрузки. Тогда объемы аппаратов в периодическом процессе примерно равны объему реакторов в непрерывном процессе, и заметных преимуществ непрерывный процесс не даст. Если еще при этом гетерогенная система склонна к расслоению или существует необходимость непрерывного дозирования твердых веществ, то преимущества непрерывного процесса будут весьма сомнительны. [12]
Это положение объясняется протеканием относительно медленной химической реакции между хлором и водой. При низких скоростях жидкости ( а поэтому и при низких скоростях абсорбции) имеется достаточное время для протекания этой реакции почти до достижения равновесия в жидкостной пленке, следовательно, в этом случае применим обычный коэффициент абсорбции. При высоких скоростях жидкости молекулы хлора абсорбируются быстрее, чем успевают прореагировать с водой в пленке, так что значительная часть растворенного хлора может проникнуть в массу жидкости в молекулярном состоянии. В этом случае движущей силой процесса диффузии является разность концентраций молекулярного хлора на поверхности раздела фаз и в основном ядре жидкости, а не разность общих концентраций хлора. [13]
Если же электрохимической стадии предшествует медленная химическая реакция, в результате которой образуются электрохимически активные частицы, то наблюдаются так называемые кинетические токи. [14]
С помощью осциллографа удается количественно исследовать медленные химические реакции, часто предшествующие собственно электрохимической стадии. [15]
Страницы: 1 2 3 4