Медленная химическая реакция
Cтраница 4
К поверхностным явлениям относятся: межфазовая-турбулентность ( гидродинамическая неустойчивость поверхности контакта фаз) и межфазовый ( энергетический) барьер переходу вещества через границу раздела фаз при медленной химической реакции или наличии поверхностно-активного вещества ( ПАВ) в жидкости. [46]
Разберем различные формы уравнений общей скорости веществ А - и В, находящихся в соответствующих фазах, начиная с процессов, которые характеризуются очень быстрыми химическими реакциями по сравнению с процессами массопередачи, и кончая процессами - с очень медленными химическими реакциями. [47]
В данном докладе на примере сложной химической реакции - жидкофазного окисления тетралина - показано практическое применение общей методики моделирования барботажных реакторов с использованием вычислительной техники, разработан алгоритм и составлена программа расчета на ЦВМ барботажного реактора, с протекающей в нем медленной химической реакцией в жидкой фазе. [48]
Медленные химические реакции в растворах сопровождаются множеством быстрых и сверхбыстрых реакций. За промежуток времени, который требуется для одного элементарного события медленной реакции, могут произойти миллионы и миллиарды элементарных событий многих быстрых и сверхбыстрых реакций. [49]
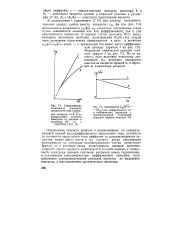 |
Схематическая зависимость плотности предельного тока выделения водорода от V ш на вращающемся дисковом электроде из платины в растворах НС1 ( / и CHsCOOH KCl ( 2.| Зависимости пр. [50] |
Усо, inp, поскольку построенные таким путем зависимости линейны как для диффузионного, так и для кинетического процессов. Медленной химической реакции отвечает прямая 2 а рис. 7.5. Из ее наклона, зная величину константы диссоциации Ка, нетрудно определить константы скорости прямой А / и обратной kb химических реакций. [51]
В связи с этим Феркло и Хиншелвуд [91] указывают, что хотя растворитель затрудняет диффузию и таким образом уменьшает число столкновений с другими молекулами, которое данная молекула растворенного вещества совершает в единицу времени, он зато зажимает молекулы растворенного вещества попарно и заставляет их повторно сталкиваться друг с другом, причем оба эффекта примерно взаимно компенсируются. Для обычных медленных химических реакций повторные столкновения столь же эффективны, как и новые столкновения. [52]
Страницы: 1 2 3 4