Данная химическая реакция
Cтраница 1
Данная химическая реакция осуществляется путем перехода от молекулярного состояния исходных веществ к ионному и снова к молекулярному. Однако в действительности это лишь одно звено цепи всех возможных превращений веществ, участвующих в данном процессе развития ( от низшего к высшему); спиралевидность при этом еще не выступает. Спиралевидность развития, выражающую действие закона отрицания отрицания, можно проследить только на длинной цепи последовательно следующих друг за другом качественных превращений, когда они связаны с усложнением и Повторяемостью тех или иных свойств на новой, более высокой основе. [1]
Данная химическая реакция показывает, что при взаимодействии двуокиси азота с водой образуется не только азотная, но и азотистая кислоты. [2]
Скорость данной химической реакции зависит от концентрации реагирующих веществ, температуры, давления, физических и химических свойств среды ( например, от свойств растворителя в случае реакций, протекающих в растворе) и от других условий. [3]
Тепловой эффект данной химической реакции не зависит от характера и последовательности отдельных ее стадий, а зависит только от начальных и конечных веществ и их физического состояния. [4]
Обычно скорость данной химической реакции при постоянных внешних условиях не остается постоянной, а изменяется во времени. Поэтому численные значения скорости реакций будут различными в зависимости от того, для какого момента или промежутка времени мы рассматриваем изменение концентраций. [5]
Для осуществления данной химической реакции требуется некоторый начальный запас энергии, достаточный для ослабления старых связей между атомами и возникновения новых. Если этот запас энергии недостаточен, то столкнувшиеся молекулы не могут преодолеть силу взаимного отталкивания и непрореагируют. Только небольшая часть активных молекул, обладающая достаточным запасом энергии для начальной стадии химической реакции, может образовать химическое соединение. [6]
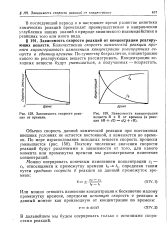 |
Зависимость скорости реакции от времени.| Зависимость концентрации веществ В и R от времени ( в реакции 6В rfD qQ / - R. [7] |
Обычно скорость данной химической реакции при постоянных внешних условиях не остается постоянной, а изменяется во времени. Поэтому численные значения скорости реакций будут различными в зависимости от того, для какого момента или промежутка времени мы рассматриваем изменение концентраций. [8]
Если в данной химической реакции наряду с газами принимают участие и твердые вещества, то концентрация последних в уравнение константы не входит. [9]
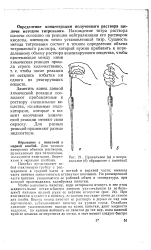 |
Правильное ( а и неправильное ( б обращение с пипеткой. [10] |
Заметить конец данной химической реакции поз-валяют прибавляемые к роствору специальные вещества, называемые индикаторами, которые в момент окончания химической реакции меняют свою окраску. Для разных реакций применяют разные индикаторы. [11]
При использовании спектральных данных и химических реакций студенты могут выполнить в течение одного семестра продолжительностью 15 недель 6 - 8 задач по расшифровке структуры индивидуальных веществ и две задачи по анализу смесей, в каждой из которых содержится 2 - 3 компонента. [12]
Так как скорость данной химической реакции зависит от температуры, то необходимо соблюдать непременное условие, чтобы температура в течение всего опыта была величиной постоянной. [13]
Рассчитать константу равновесия данной химической реакции и определить, какое из веществ: фосфорная или фосфористая кислота - более устойчиво в водных растворах. [14]
Ответ: Скорость данной химической реакции при уменьшении давления в 2 раза уменьшится в 16 раз. [15]
Страницы: 1 2 3 4