Данная реакция
Cтраница 3
Данная реакция, схематически показанная ниже ( уравнение 44), безусловно является самой известной и наиболее широко изученной реакцией с участием сульфонильной группы. Эта перегруппировка происходит при обработке основанием а-галоген-сульфона ( 81), содержащего в - положении атом водорода, приводит к алкену ( 83) со строго определенным положением двойной связи. Имеется довольно много данных, четко указывающих на то, что пнтермедиатами в этой перегруппировке являются ти-иран - 1 1 -диоксиды ( 82), называемые также эписульфонами. Эти соединения не удается получить в условиях реакции Рамберга - Беклунда. В условиях реакции Рамберга - Беклунда из них образуются алкены ожидаемого строения. [31]
Данная реакция положена в основу фотометрического определения малых концентраций вторичных аминов в воздухе: диметил-амина, диэтиламина, морфолина, пиперидина, этиленимина, гек-саметиленимина. Она с успехом может быть использована для определения других вторичных аминов. [32]
Данная реакция происходит при энергии электронов около 9 эв. [33]
Данная реакция обратима, равновесие полностью сдвинуто влево ниже 700 С при нормальном давлении и вправо при температурах выше 1700 С. В интервале 700 - 1700 С присутствуют как радикальные, так и молекулярные формы. Однако в ходе пиролиза возможны различные радикал-радикальные и радикал-молекулярные реакции, поэтому конечные продукты пиролиза очень разнообразны. Соединения с относительно слабыми ковалентными связями, давая радикалы при более низких температурах, служат хорошими источниками радикалов. Например, органические перекиси, содержащие слабую - 0 - 0 - связь, являются широко распространенными и удобными источниками радикалов в газах и растворах. [34]
Данная реакция имеет практическое значение, поскольку она определяет снижение чувствительности дозиметра Фрике по отношению к органическим примесям, если к раствору ферросульфата добавляют хлористый натрий. [35]
Данная реакция имеет не только препаративный, но и теоретический интерес, поскольку свидетельствует о большей основности аминофссфина по отношению к борану по сравнению с триметиламином. Замещение амина на аминофосфин происходит даже при ксмнатной температуре, хотя сравнительно медленно. При умеренном нагревании ( 80 - 100) реакция заканчивается быстро. Реакция является обратимой, и при проведении ее в закрытой системе устанавливается равновесие, сдвинутое на 80 % вправо. [36]
Данные реакции идут очень интенсивно и используются в органическом синтезе. [37]
Данная реакция уже при температурах 50 - 100 С протекает с заметной скоростью и каталитически ускоряется ионами меди и никеля; при 200 С скорость реакции уже настолько велика, что практически с наличием Fe ( OH) 2 или какого-либо другого окисла, кроме магнетита, в воде обычных теплосиловых установок можно не считаться. Сведения по растворимости отдельных форм окислов железа и их гидратов чрезвычайно противоречивы, что объясняется очень большими трудностями проведения эксперимента с окислами железа. Не останавливаясь поэтому на рассмотрении всех данных, можно отметить, что математическая обработка экспериментальных данных по пару, полученных МЭИ и ИЭ Грузинской АН, позволяет оценить равновесную концентрацию гидратной формы, отвечающей твердой фазе Fe3O4 в воде при 250 - 300 С, величиной около 100 мкг / кг. [38]
Данная реакция протекает заметно медленнее, чем аналогичная реакция фторирования четырехфтористого урана, которая хорошо проходит при 300 С. [39]
Данная реакция является только схемой, так как в действительности образуются различные комплексные ионы циркония с фтором. Добавление фторидов щелочных металлов или аммония усиливает растворяющее действие кислот, в том числе и органических, хотя не так энергично, как в случае титана. [40]
Данная реакция сильно экзотермична. Поэтому реакция разложения И2О2 необратима. Молекулы Н2О2 неустойчивы и все же могут существовать потому, что для их разложения требуется значительная энергия активации. В водном растворе разложение перекиси водорода интенсивно идет при повышенной температуре. При добавлении к водным растворам Н2О2 каталитически действующих веществ ( например, МпО2, РЬО2, соли, содержащие ион Си2, и др.) разложение ее может протекать и при комнатной температуре. Перекись водорода - сильный окислитель; она нередко используется для окисления различных веществ. [41]
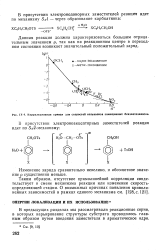 |
Корреляционная кривая для скоростей сольволиза замещенных бензилтозилатов. [42] |
Данная реакция должна характеризоваться большим отрицательным значением р, так как на реакционном центре в переходном состоянии возникает значительный положительный заряд. [43]
Данная реакция представляет большой практический интерес для промышленного синтеза а-окисей олефинов. [44]
Данная реакция по условиям ее осуществления в промышленности приближается к реакции, лежащей в основе предлагаемого способа каталитической очистки сточных вод акрилатных производств от органических загрязнений. [45]
Страницы: 1 2 3 4