Значение - ионный радиус
Cтраница 2
Вычислив, таким образом, значение ионного радиуса для одного аниона, можно из других соединений вычислить радиусы и других катионов и анионов. [16]
Из таблицы видно, что значения ионных радиусов от лантана до лютеция изменяются в небольшом интервале: от 1 22 до 0 99 А - Нельзя не обратить внимания на то обстоятельство, что наблюдаемая в общем постепенность в изменении ионных радиусов иногда заметно нарушается. Особенно это следует отметить для лантана, радиус иона которого отличается от радиуса иона соседнего с ним церия на 0 04 А, тогда как у всех последующих соседних элементов разница в размере ионного радиуса составляет всего лишь 0 01 или 0 02 А. Из приведенных выше величин ионных радиусов видно, что иттрпй по величине ионного радиуса попадает между диспрозием и гольмием, что подтверждается трудностью разделения пары Y-Но при фракционной кристаллизации. Скандий по величине ионного радиуса резко отличается от редкоземельных элементов. Именно этим и обусловливается сравнительная легкость его отделения. [17]
Из таблицы видно, что значения ионных радиусов от лантана до лютеция изменяются в небольшом интервале: от 1 22 до 0 99 А. Нельзя не обратить внимания на то обстоятельство, что наблюдаемая в общем постепенность в изменении ионных радиусов иногда заметно нарушается. Особенно это следует отметить для лантана, радиус иона которого отличается от радиуса иона соседнего с ним церия на 0 04 А, тогда как у всех последующих соседних элементов разница в размере ионного радиуса составляет всего лишь 0 01 или 0 02 А. Из приведенных выше величин ионных радиусов видно, чтогиттрий по величине ионного радиуса попадает между диспрозием и гольмием, что подтверждается трудностью разделения пары Y-Но при фракционной кристаллизации. Скандий по величине ионного радиуса резко отличается от редкоземельных элементов. Именно этим и обусловливается сравнительная легкость его отделения. [18]
Приведенные в этом параграфе и далее значения эффективных ионных радиусов определены исходя из характеризующихся координационным числом 6 структур типа NaCl, причем за основу брали соединения, в которых взаимное влияние химической природы ионов должно быть минимальным. [19]
В табл. 55 в верхних строчках приведены значения нормальных ионных радиусов ( ги) элементов групповой валентности, во вторых - нормальные ионные рефракции. [20]
 |
Молекулярная ионная пара. [21] |
В табл. 55 в верхних строчках приведены значения нормальных ионных радиусов ( г) элементов групповой валентности, во вторых - нормальные ионные рефракции. [22]
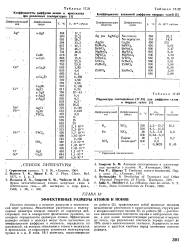 |
Коэффициенты взаимной диффузии твердых солей. [23] |
Зарядность ионов указана в круглых скобках перед значением ионного радиуса. [24]
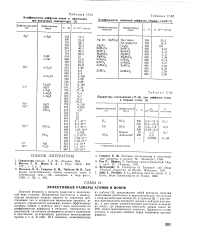 |
Коэффициенты взаимной диффузии твердых солей. [25] |
Зарядность иснов указана в круглых скобках перед значением ионного радиуса. [26]
В таблицах обычно приводят и в настоящее время используют значения ионных радиусов по Гольдшмидту или Полингу. Далее в тексте, если особо не указано, будем пользоваться радиусами по Полингу. [27]
К табл. 92 и 93 имеется много дополнений - значений ионных радиусов для различных валентностей и КЧ. [28]
При этом было найдено, что лучшее совпадение опытных и теоретических данных происходит при использовании значений ионных радиусов Гурари и Адриана. Однако сделать определенные выводы на основании результатов сравнения трудно из-за сомнений в правильности опытных значений 1 / - [ эксп. [29]
Использование приведенной выше формулы для энергии решетки позволяет, как было показано Полингом [2], теоретически вывести значения ионных радиусов. Из предыдущего следует ( гл. [30]
Страницы: 1 2 3 4