Значение - ионный радиус
Cтраница 4
Вскоре после того, как был сформулирован первый ряд грубых значений атомных радиусов для кристаллов всех типов [ W. L. Bragg, Phi... Между 1920 и 1927 гг. Ланде, Вазаштерна, Гольдшмидтом и Паулингом были составлены полные ряды значений ионных радиусов; эта работа будет изложена в гл. В том же году Гольдшмидт опубликовал значения атомных радиусов, полученные из металлов и из неметаллических ковалентных кристаллов [ V. [46]
По тем же причинам радиусы ионов редких земель и актинидов уменьшаются с ростом порядкового номера. Это так называемое ланлганидное сжатие так велико, что следующие за редкими землями элементы - гафний, тантал и вольфрам - имеют почти те же значения ионных радиусов, что и их более легкие аналоги - цирконий, ниобий и молибден. [47]
По тем же причинам радиусы ионов редких земель и актинидов уменьшаются с ростом порядкового номера. Это так называемое лантпанидное сжатие так велико, что следующие за редкими землями элементы - гафний, тантал и вольфрам - имеют почти те же значения ионных радиусов, что и их более легкие аналоги - цирконий, ниобий и молибден. [48]
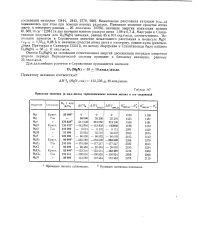 |
Принятые значения ( в кал / моль термохимических величин магния и его соединений. [49] |
Межатомные расстояния нитридов ( гМе - м) оценивались при этом при помощи ионных радиусов. Принимая значение сродства атома азота к электрону равным - 26 ккал / моль [2769], значение энергии Ионизации магния 61 669 14 см 1 [ 29411 и два значения ионного радиуса азота 1 08 и 0 7 А, Маргрейв и Стапи-танонда получили для D0 ( MgN) значения, равные 45 и 101 ккал / моль, соответственно. Используя принятое в Справочнике значение межатомного расстояния в молекуле MgN rMe N 1 55 0 08 А и значение сродства атома азота к электрону, равное нулю ( рекомендация Притчарда и Скиннера [3331]), по методу Маргрейва и Стапитанонды было найдено D0 ( MgN) 38 11 ккал / моль. [50]
Не останавливаясь на многочисленных аналогичных попытках в последующие годы, заметим, что завершением развития эмпирической системы являются работы Шэннона и Прюита [152, 153], которые получили наиболее подробную и точную таблицу ионных радиусов. В табл. 93 даны дополнения к этой системе. Значения ионных радиусов для других КЧ могут быть вычислены по поправкам Захариазена или с помощью уравнения (2.9), которое позволяет рассчитать любые радиусы для любого КЧ. [51]
В противовес алюминию металлы подгруппы галлия относятся к малораспространенным и рассеянным элементам. Ввиду близости значений ионных радиусов А1 ( 3) и Ga ( 3) галлий частично замещает алюминий в бокситах. Кроме того, параметры решеток GaS и ZnS почти одинаковы, а потому галлий способен входить в виде примеси в сфалерит. Все это приводит к тому, что галлий присутствует в бокситах, сфалерите и полиметаллических рудах. Затем выделяют галлий электролизом сильнощелочных растворов гидроксида. Полученный продукт содержит не более 99 5 % основного металла. Галлий высокой чистоты получают переплавкой в вакууме. [52]
В противовес алюминию металлы подгруппы галлия относятся к малораспространенным и рассеянным элементам. Ввиду близости значений ионных радиусов А1 ( - - 3) и Ga ( 3) галлий частично замещает алюминий в бокситах. Кроме того, параметры решеток GaS и ZnS почти одинаковы, а потому галлий способен входить в виде примеси в сфалерит. Все это приводит к тому, что галлий присутствует в бокситах, сфалерите и полиметаллических рудах. Затем выделяют галлий электролизом сильнощелочных растворов гидроксида. Полученный продукт содержит не более 99 5 % основного металла. Галлий высокой чистоты получают переплавкой в вакууме. [53]
В настоящее время в литературе имеется несколько таблиц ионных радиусов. Объясняется это обстоятельство главным образом тем, что в основу таблицы авторами кладутся разные величины исходных ионных радиусов. Отсюда резкое расхождение в значениях ионных радиусов двувалентных трехвалентных металлов, определяемых главным образом из структур их окислов, в таблицах Гольдшмидта и Полинга. Нет сомнения в том, что В. М. Гольдшмидт преуменьшил значение радиуса иона кислорода, но и величина 1 40, несомненно, слишком велика. [54]
 |
Схема определения радиуса иона. [55] |
В настоящее время в литературе имеется несколько таблиц ионных радиусов. Объясняется это обстоятельство главным образом тем, что в основу таблицы авторами кладутся разные величины исходных ионных радиусов. Отсюда резкое расхождение в значениях ионных радиусов двухвалентных и трехвалентных металлов, определяемых главным образом из структур их окислов, в таблицах Гольдшмидта и Полинга. Нет сомнения в том, что В. М. Гольдшмидт преуменьшил значение радиуса иона кислорода, но и величина 1 40, несомненно, слишком велика. [56]
Таблицы ионных радиусов, составленные различными авторами, обычно несколько отличаются друг от друга. Поэтому для всех ионов необходимо пользоваться значениями только из какой-либо одной самосогласованной таблицы. Одним из наиболее полных наборов значений ионных радиусов является таблица, составленная Аренсом [ A h r e n s, Geochim. Значения для заряженных частиц, приведенные в табл. 11, относятся к координационному числу шесть и взяты из таблицы Аренса. В таблицу включены также значения так называемых ковалентных радиусов Полинга, которые передают приблизительные размеры атомов, связанных ординарной связью с другими такими же атомами. [57]
Из уравнения ( 68) сразу видно, что, если ионы А и В имеют противоположные знаки, то угловой коэфициент будет положительным, и, наоборот, он будет отрицательным при одинаковых зарядах. Экспериментальные результаты находятся в согласии с теоретическими выводами. Если сделать правдоподобные предположения о значениях ионных радиусов, то по уравнениям ( 68) и ( 69) можно вычислить угловые коэфициенты линейной зависимости In А, от 1 / D, которые находятся в превосходном согласии с опытом. [58]
Страницы: 1 2 3 4