Значение - ионный радиус
Cтраница 3
Какую из двух возможных кристаллических структур ( а именно структур MgF2 и CaF2) следует приписать BaF2, основываясь на значениях ионных радиусов. [31]
Самому легкому элементу III группы - скандию присуще только одно состояние окисления - Sc1; у иона скандия очень небольшой радиус, не попадающий в область значений ионных радиусов лантанидов, так что, хотя скандий и напоминает другие рассматриваемые здесь элементы, он существенно отличается во многих отношениях и требует отдельного обсуждения. [32]
 |
Ионные радиусы по Гольдшмидту. [33] |
Однако для радиусов ионаР и иона О2 - Вазастьерна получил значения ( 1 33 и 1 32 А), которые были настолько близки к их истинным радиусам, что Гольдшмидт [1] смог использовать их для расчета других ионных радиусов из межатомных расстояний в кристаллах и показать, что сумма этих радиусов с хорошим приближением воспроизводит многие межатомные расстояния. Дополненные новыми данными значения ионных радиусов по Гольдшмидту приведены на рис. 11.1 и в табл. 11.1. Эти данные вычислены для координационного числа б и октаэдрического окружения. [34]
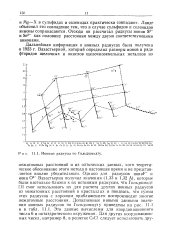 |
Ионные радиусы по Гольдшмидту. [35] |
Однако для радиусов ионаР - и иона О2 Вазастьерна получил значения ( 1 33 и 1 32 А), которые были настолько близки к их истинным радиусам, что Гольдшмидт [1] смог использовать их для расчета других ионных радиусов из межатомных расстояний в кристаллах и показать, что сумма этих радиусов с хорошим приближением воспроизводит многие межатомные расстояния. Дополненные новыми данными значения ионных радиусов по Гольдшмидту приведены на рис. 11.1 и в табл. 11.1. Эти данные вычислены для координационного числа 6 и октаэдрического окружения. [36]
Здесь же приводятся значения ко-валентных тетраэдрических ионных радиусов в соответствии с характером ионизации указанных элементов в германии. [37]
Размеры ионов в кристаллах характеризуются понятием ионного радиуса. Существуют различные шкалы значений ионных радиусов, составленные таким образом, чтобы сумма двух радиусов равнялась равновесному расстоянию между соприкасающимися ионами в кристалле. В конечном итоге они не сильно отличаются друг от друга. [38]
Элементарные ячейки кварцевых форм AHIBV04 имеют вдвое больший параметр с ввиду наличия в соединениях двух сортов тетраэдров с их упорядоченным расположением вдоль винтовой оси цепочки, совпадающей с направлением с-параметра. Эти данные наряду со значениями ионных радиусов ( см. табл. 4) демонстрируют закономерное изменение важнейших метрических характеристик фаз в зависимости от состава по всей группе рассматриваемых тетраэдриче-ских и октаэдрических аналогов кремнезема. [39]
Ас часто изоструктурны, причем с ростом атомного номера параметры кристаллич. По мере увеличения заряда ядра снижаются значения ионных радиусов, т.е. наблюдается актиноидное сжатие ( аналогичное лантаноидному сжатию), обусловленное последоват. [40]
В системах с гидроокисями двухвалентных металлов при увеличении расхождения между значениями ионных радиусов катионов наблюдается переход от непрерывного ряда твердых растворов замещения ( система с Са ( ОН) 2), через ограниченный ряд твердых растворов ( до 50 мол. В системах с гидроокисями А1, Сг и Fe ( III) образуются структуры с двуслойной гексагональной решеткой, в которой промежуточные слои Me ( ОН) 2 более упорядочены. [41]
В системах с гидроокисями двухвалентных металлов при увеличении расхождения между значениями ионных радиусов катионов наблюдается переход от непрерывного ряда твердых растворов замещения ( система с Са ( ОН) 2), через ограниченный ряд твердых растворов ( до 50 мол. В системах с гидроокисями А1, Сг и Fe ( III) образуются структуры с двуслойной гексагональной решеткой, в которой промежуточные слои Me ( OH) 2 более упорядочены. [42]
Изучив редкоземельные скан-даты, ванадиты, галлиаты и ортохроматы, принадлежащие к структуре типа перовскита, Геллер определил эффективные радиусы ионов в этих соединениях. В частности, он установил, что в структурах типа перовскита значения ионных радиусов Sc3 и Y3 равны 0 685 и 0 771 А. [43]
 |
Значения различных типов радиусов. [44] |
Первые значения ионных радиусов были определены Ланде в 1920 г. в предположении, что в галогенидах лития ионы галогена находятся в контакте. Позднее Полинг предложил улучшить данные Гольдшмидта, приняв для иона О2 - значение ионного радиуса 1 40 А. Именно эти исправленные значения общеприняты в настоящее время как гольдшмидтовские эмпирические ионные радиусы. [45]
Страницы: 1 2 3 4