Значение - термодинамические свойство
Cтраница 2
В процессе согласования данных о жидкости и газе на изобарах был также изменен ряд значений термодинамических свойств при околокритических температурах ( v при 155 - 160 К; i при 155 - 165 К; s при 155 - 170 К и Ср при 140 - 180 К), в связи с чем данные на этих изотермах были, дополнительно сглажены графически. [16]
В соответствии с различием стандартных состояний в справочных таблицах термодинамических свойств часто дают несколько значений стандартных термодинамических свойств одного и того же вещества. [17]
Расчет теплоты образования CS по экспериментальным данным Шефера и Виде-мейера и принятым в Справочнике значениям термодинамических свойств компонентов этой реакции приводит к A fo ( CS, газ) 57 7 ккал / моль. [18]
Результаты расчета состава продуктов диссоциации окиси стронция в конденсированном состоянии по принятым в Справочнике значениям термодинамических свойств соответствующих веществ приведены ниже. [19]
В силу принятой взаимонезависимости Q, вычисления для каждой степени свободы производятся раздельно Очевидно также, что, суммируя значения соответствующих термодинамических свойств, найденных по величинам Qt, мы получим данное свойство газа в целом. [20]
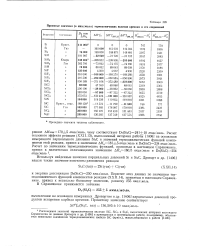 |
Принятые значения ( в кал / моль термохимических величин кремния и его соединений. [21] |
Расхождение значений термохимических величин SiC, SiCa и SiaC, вычисленных авторами настоящего Справочника по данным Дроварта и др. [1406] и приведенных в оригинальной работе, по-видимому, объясняется неверными значениями термодинамических свойств SiC ( крист. [22]
Таблицы термодинамических свойств веществ в конденсированных состояниях содержат данные для температур 293 15; 298 15; 400 и далее через 100 до температуры, при которой давление паров достигает величины порядка 100 атм. В этих таблицах приводятся также значения термодинамических свойств при температурах плавления и полиморфных превращений вещества. [23]
В работах [9, 10] рассмотрены органические соединения, имеющие не более двух углеродных атомов подряд, однако круг таких соединений довольно велик. К сожалению, в справочниках [9, 10] даются значения термодинамических свойств только при 298 15 К и температуры и энтальпии фазовых превращений. И здесь тоже значительно больше пробелов, чем численных данных. [24]
В работе f8 ] нами были оценены значения термодинамических свойств диантрацена как индивидуального вещества. Однако при этом пришлось пренебречь растворимостью антрацена и диантрацена в кристаллах ФМ: в расчетах принимали, что они состоят только из дпмеров. [25]
В формулах нулевого приближения, как уже было отмечено, влияние отклонений от хаотического распределения не учитывается. Поэтому сравнение формул первого приближения с формулами нулевого приближения позволяет установить, как отражается на значениях термодинамических свойств растворов учет отклонений от хаотического распределения. [26]
Предложен общий метод для решения обратной задачи в случае обработки экспериментальных данных по равновесиям в газовой фазе. Метод позволяет проанализировать все возможные гипотезы о молекулярном составе изучаемой системы, рассчитать термодинамические характеристики независимых реакций, получить взаимно-согласованные значения термодинамических свойств системы, а также наметить пути планирования уточняющих экспериментов. Метод иллюстрируется на примерах обработки данных статического метода, метода потока и метода взрыва для системы кремний-хлор-водород. [27]
Ниже приведен состав продуктов испарения окиси кальция. Парциальные давления Са, Оа и О, образующихся в результате диссоциации окиси кальция в конденсированном состоянии, были вычислены на основании принятых в Справочнике значений термодинамических свойств этих веществ. [28]
В настоящее время практически для всех газов, используемых в криогенной технике, построены термодинамические диаграммы [64, 77, 87], позволяющие с достаточной точностью проводить расчеты основных термодинамических процессов. Кроме того, в последние годы в результате работ ряда исследователей в СССР и за рубежом для большинства технически важных криопродуктов были составлены уравнения состояния, справедливые для широкого диапазона температур и давлений, на основании которых были рассчитаны подробные таблицы значений термодинамических свойств. Из этих работ прежде всего необходимо отметить справочные данные по свойствам четырех технически важных криопродуктов: воздуха, азота, кислорода и аргона [12, 13], в которых наряду с термическими и калорическими величинами приводятся и подробные таблицы коэффициентов переноса. [29]
Звездочкой отмечены значения свойств, найденные а результате приближенного расчета, двумя звездочками - - величины AGl g, вычисленные по уравнению AG298 A / / 298 - - 298, 2AS298 на основании значений ASMS, почерпнутых в работах последних лет. Использованы следующие сокращенные обозначения: г - газообразное, ж-жидкое, к - кристаллическое, ст-стеклообразное, ам - аморфное; р - относится к разбавленному раствору. Значения термодинамических свойств индивидуальных ионов даны для водного раствора: они отнесены х иону Н, для которого в стандартном состоя нвди они приняты равными пулю. Срмн сопровождается ссылкой на литературу. Библиография приведена после таблиц. [30]
Страницы: 1 2 3