Значение - термодинамические свойство
Cтраница 3
Звездочкой отмечены значения свойств, найденные в результате приближенного расчета, двумя звездочками - величины AGiss. Использованы следующие сокращенные обозначения: г - газообразное, ж - жидкое, к - кристаллическое, ст - стеклообразное, ам - аморфное; р - откосится к разбавленному раствору. Значения термодинамических свойств индивидуальных ионов даны для водного раствора: они отнесены к иону И, для которого в стандартном состоянии они приняты равными нулю. AG gg, 5 98 и / 298 сопровождается ссылкой на литературу. Библиография приведена после таблиц. [31]
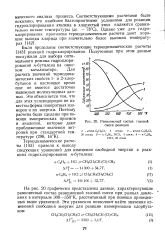 |
Равновесный состав газовой смеси реакции. [32] |
Были проделаны соответствующие термодинамические расчеты [143] реакций гидрохлорирования. Полученные при этом данные послужили для выбора оптимального режима гидрохлорирования н-бутилена на окис-ном катализаторе. Для расчета значений термодинамических свойств 1 - и 2-хлор-бутанов в настоящее время еще не имеется достаточно надежных молекулярных данных. Это объясняется тем, что для этих углеводородов не известны формы поворотных изомеров и их энергии. [33]
Предполагая, что продуктами испарения являются Si ( газ) и SiC ( газ), они вычислили количество SiC ( крист. По этим данным с использованием принятых в Справочнике значений термодинамических свойств было вычислено значение теплоты сублимации SiC, равное 143 ккал / моль. [34]
В книге рассмотрены наиболее распространенные уравнения состояния для жидкости, обоснована форма уравнения состояния, справедливого в широком интервале температур и плотностей, и. Критически проанализированы экспериментальные и расчетные данные о термических и калорических свойствах жидких азота, кислорода, аргона и воздуха. На основе составленных уравнений состояния для этих веществ получены подробные таблицы значений термодинамических свойств от кривой насыщения до давления 500 бар и температуры 150 - 180 К - По табличным данным для каждого вещества построены диаграммы состояния: плотность - температура, энтальпия - давление и энтропия - давление. [35]
Однако условия, при которых находятся сравниваемые между собой части, могут быть и не одинаковыми. Так, в непрерывных системах свойства изменяются от точки к точке вслед за изменением внешних условий, например потенциала внешнего силового поля. В фазах переменного состава ( растворах) часто возникает необходимость выяснить, относятся или нет к единой фазе растворы разных концентраций одних и тех же веществ. Эндрюс), значения интенсивных термодинамических свойств уже не могут служить непосредственно признаком фазовой принадлежности веществ, поскольку эти свойства зависят от внешних условий - в которых вещества находятся, а условия здесь разные. Для идентификации фаз можно тогда использовать взаимную зависимость свойств вещества: каждая фаза имеет свое характерное, выражающее эту зависимость, уравнение, пользуясь которым можно выяснить термодинамические состояния сравниваемых веществ при одинаковых условиях. [36]
Страницы: 1 2 3