Значение - степень - диссоциация
Cтраница 1
Значения степени диссоциации а, полученные указанными методами, лучше всего совпадают в случае разбавленных растворов 1 - 1-зарядного электролита. [1]
Значения степени диссоциации одного и того же сильного электролита могут различаться при разных методах ее определения, поэтому константы диссоциации, вычисленные из степени диссоциации, зависят как от концентрации электролита, так и от метода измерения а. Таким образом, константы диссоциации сильных электролитов не являются постоянными. В то же время нет никаких экспериментальных указаний на наличие в растворе сильного электролита молекул типа NaCl, Na2SO4, и т.п., хотя по значениям степени диссоциации концентрация должна быть вполне достаточной для их обнаружения. Все эти проблемы разрешает теория сильных электролитов. [2]
Значение степени диссоциации, рассчитанное по уравнению ( 231) без учета коэффициентов активности, обычно называют кажущейся или эффективной степенью диссоциации. [3]
Значение степени диссоциации соединений находят на основании данных о константах их диссоциации при температуре пламени и парциальных давлениях радикалов, образующих эти соединения, в газовой фазе. [4]
Приводится несколько значений степени диссоциации а и соответствующих им изотонических коэффициентов i. Следует установить, к каким именно электролитам относятся данные, и вычислить для них величины теплот растворения QL на основании цикла Габера - Борна. [5]
Если определить по электропроводности значение степени диссоциации для растворов сильного электролита с различной концентрацией, а затем попытаться вычислить константы диссоциации, то они окажутся непостоянными. [6]
Если по электропроводности определить значение степени диссоциации для растворов сильного электролита с различной концентрацией, а затем вычислять константы диссоциации, то они окажутся непостоянными. [7]
В табл. 3 приведены значения степени диссоциации различных арилэтанов в 0 1 М растворе в бензоле при 25 С. [8]
Вычисленные Хиллом и Сиркаром значения степени диссоциации HF здесь не приводятся, так как авторы не учитывали роли изменения вязкости в концентрированных растворах. Кроме того, для электропроводности при бесконечном разбавлении и 0 они избрали грубо ошибочное значение Л, равное 325, резко преуменьшив этим вычисленные ими степени диссоциации HF; принятое этими авторами значение для электропроводности Л 364 близко к правильному. Именно этим объясняется ошибочный вывод Хилла и Сиркара о том, что степень диссоциации HF возрастает с температурой. [9]
Особенно велика разница в значениях степени диссоциации кислот. [10]
При каких условиях возможно сравнение значений степеней диссоциации слабых электролитов. [11]
В табл. 30 - 1 приведены значения степени диссоциации для растворов сильного ( НС1) и слабого ( СН3СООН) электролитов. Четко видна зависимость степени диссоциации от концентрации и очень малое ее значение для уксусной кислоты. [12]
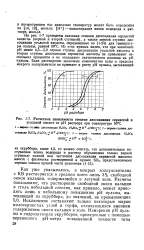 |
Расчетные зависимости степени диссоциация сернистой и угольной кислот от рН раствора при температуре 50 С. [13] |
На рис. 1 - 7 приведены значения степени диссоциации сернистой кислоты ( первой и второй ступеней), а также первой ступени диссоциации угольной кислоты, определенные по ( 1 - 24) для температуры пульпы, равной 50 С. Из этих кривых видно, что при значениях рН менее 4 5 - 5 0 первая ступень диссоциации угольной кислоты и вторая ступень диссоциации сернистой кислоты не превышают нескольких процентов и яе оказывают значительного влияния на рН пульпы. [14]
Парциальные равновесные давления могут быть подсчитаны из значений степеней диссоциации водяного пара. [15]
Страницы: 1 2 3