Редокс-потенциал
Cтраница 2
Измерение редокс-потенциалов может осложняться еще и тем, что часто нельзя избежать диффузионного потенциала из-за существования границы жидкость / жидкость. Кроме того, вследствие побочных процессов, таких как гидролиз, комплексообразование и др., неизвестны с достаточной точностью истинные концентрации окисленной и восстановленной форм. По этим причинам, а также потому, что во многих работах активности ионов отождествлялись с концентрациями, в литературе зачастую приводятся различные значения стандартных редокс-потенциалов. [16]
 |
Схематическое изображение проточных потенциометрических. [17] |
Измерение редокс-потенциалов как аналитических сигналов в жидкостной хроматографии используется редко. Гораздо чаще применяются электроды второго рода, которые более селективны по сравнению с инертными редокс-электродами. [18]
Измерение редокс-потенциала производится электрометрическим методом. Электродная система составляется из платинового пластинчатого электрода с гладкой поверхностью ( общая площадь 4 - б см) и стандартного электрода сравнения - каломельного или хлорсеребряного. Измерительные электроды из платиновой черни, в том числе типа ЭТПЛ, выпускаемые нашей промышленностью для измерения фо в сточных водах, менее пригодны, так как обладают каталитическими свойствами: сорбированный на их поверхности водород изменяет состав воды в приэлектродном пространстве. [19]
Значение редокс-потенциала для кремния несколько выпадает из общего ряда, что, как и его малая химическая активность, объясняется большой прочностью решетки и большой энергией активации тех реакций, в которые вступает этот элемент. При высоких температурах активность кремния довольно велика. Отсюда следует, что по приведенным выше данным о потенциалах еще нельзя делать уверенных выводов о химической активности элементов. [20]
 |
Окислительно-восстановительный ( редокс элемент с. [21] |
Величины редокс-потенциалов определяются природой раствора, соотношением концентраций окисленной и восстановленной форм и температурой. [22]
Колебания редокс-потенциала были отмечены и при замене малоновой кислоты в реакции Б - Ж фосфорно-уксусной ( РАА) [90], при этом было изучено влияние различных концентраций реагентов ( РАА, Се ( IV), ВгО3 - и Нг5О4) на продолжительность индукционного периода, величину периода колебаний редокс-потенциала и общее число колебаний. [23]
Измерение редокс-потенциала производится электрометрическим методом. Электродная система составляется из платинового пластинчатого электрода с гладкой поверхностью ( общая площадь 4 - 6 см2) и стандартного электрода сравнения - каломельного или хлорсеребряного. Измерительные электроды из платиновой черни, в том числе типа ЭТПЛ, выпускаемые нашей промышленностью для измерения фо в сточных водах, менее пригодны, так как обладают каталитическими свойствами: сорбированный на их поверхности водород изменяет состав воды в приэлектродном пространстве. [24]
Вначале рассчитывают редокс-потенциал по уравнению Нерн-ста для тех веществ, которые находятся в виде титруемого раствора, так как концентрацию этих веществ удобнее рассчитывать. Вместо концентраций можно брать величины пропорциональные им. [25]
Вначале рассчитывают редокс-потенциал по уравнению Не-рнста для тех веществ, которые находятся в виде титруемого раствора, так как концентрацию этих веществ удобнее рассчитывать. Вместо концентраций можно брать величины, пропорциональные им. [26]
При этом равновесный редокс-потенциал должен находиться выше потенциала пассивации Еп, но не выше потенциала транспассивации Ет. В этих условиях коррозионный потенциал может установиться только в пассивной области. Соответствующая среда является пассивирующей. [28]
Исследование колебаний редокс-потенциала в каталитической и некаталитической реакции окисления натриевой соли 3-ализаринсульфоновой кислоты броматом калия в H2SO4 было проведено Гупта и др. [88], ими также предложен механизм реакции. [29]
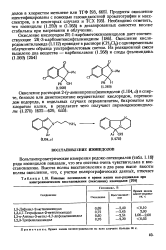 |
Пиковые потенциалы и время жизни иои-радикалов при электрохимическом восстановлении ( окислении изоиндолов. [30] |
Страницы: 1 2 3 4
