Редокс-потенциал
Cтраница 4
Из приведенных значений редокс-потенциалов видно, что окислительные свойства у Н2О2 выражены сильнее, чем восстановительные. [46]
Чем положительное величина редокс-потенциала, тем выше окислительная активность полуэлемента. [47]
На основании близости редокс-потенциала триптиценхинона LXIV ( 0 666 в) к величине для инданхинона LXV ( 0 641 в) и существенно отличного от значения для ге-бензохинона ( 0 711 в) Бартлетт и др. [881] сделали вывод, что, вероятно, угол 9 в молекуле должен быть больше 109 28, а угол а120 и, следовательно, молекула слегка напряжена. [48]
Отсюда следует, что редокс-потенциал определяется отношением активностей окисленного и восстановленного состояний. [49]
Добавки, легко повышающие редокс-потенциал раствора, например небольшие количества бихроматов, ускоряют коррозию, так как они немного увеличивают потенциал; большие - количества таких добавок, поднимающие потенциал выше 250 мв, надежно пассивируют также границы зерен и залечивают дефектные места в пленках, так что коррозия резко уменьшается. [50]
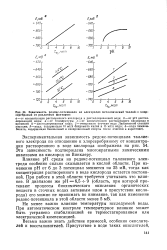 |
Зависимость редокс-потенциала на электродах металлический таллий - хлор-серебряный от различных факторов. [51] |
Влияние рН среды на редокс-потенциал таллиевого электрода особенно сильно сказывается в кислой области. При изменении рН от 6 до 3 потенциал меняется на 25 мВ, тогда как концентрация растворенного в воде кислорода остается постоянной. При работе в этой области требуется учитывать это влияние. [52]
Следовательно, учитывая величины редокс-потенциалов этих пар, реакция должна была бы идти в сторону образования 2Си2 и 41, но на самом деле она протекает слева направо. [53]
Таким образом, ряд редокс-потенциалов позволяет количественно оценить активность окислителя и восстановителя, направление и интенсивность протекания окислительно-восстановительной реакции. [54]
При переходе к микроаэрофильным условиям редокс-потенциал уменьшается, рН увеличивается и металлы начинают выпадать в осадок в виде сульфатов и карбонатов [262], что уменьшает их концентрацию в фильтрующихся водах. Картина еще больше усложняется, если учесть, что при низких значениях Eh тяжелые металлы образуют комплексы с ионами аммония и гуминовыми кислотами. [55]
За время роста аэробных микроорганизмов редокс-потенциал уменьшается, так как потребляется кислород и в среде накапливаются восстановленные продукты. [56]
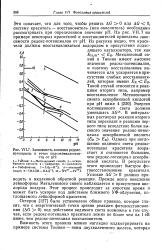 |
Зависимость значения редокс-потенциала в точке полуэквивалентности от рН. [57] |
Однако при поглощении видимого света редокс-потенциал красителя возрастает и становится большим, чем редокс-потенциал аскорбиновой кислоты. В результате этого происходит быстрое фотовосстановление красителя. Условие AG 0 должно приводить к медленной обратной реакции. Прежде всего окисление лейкоформы Метиленового синего наблюдается в присутствии кислорода воздуха. Этот процесс происходит за короткое время и может быть ускорен под действием ближнего УФ-облучения, поглощаемого лейкоформой красителя. [58]
Страницы: 1 2 3 4