Редокс-реакция
Cтраница 2
Схема ( II) охватывает многообразие редокс-реакций и ее широко используют для нахождения стехиометрических коэффициентов подобных реакций. [16]
Нерасходуемый электрод химически не участвует в электродной редокс-реакции, поэтому равновесный потенциал для таких реакций не зависит от природы электрода. Вместе с тем правильный выбор нерасходуемого электрода очень важен для эффективной реализации реакции. Материал электрода должен удовлетворять ряду требований. Он должен быть в заданных условиях химически и электрохимически устойчивым и не подвергаться коррозии. Он должен быть каталитически активным и обеспечивать протекание целевой электродной реакции с достаточной скоростью. Каталитическая активность должна быть селективной и все возможные побочные реакции должны быть максимально заторможены. Выбор оптимального электродного материала зависит от природы реакции и от условий ее проведения. [17]
 |
Примеры использования электрокаталитических реакций. [18] |
При этом возможно протекание трех типов редокс-реакций субстрата, каждая из которых характеризуется своей константой скорости. Различие между первыми двумя случаями обусловлено различиями в сольватации частиц на поверхности и внутри слоя. [19]
Как было указано выше, между редокс-реакциями и кислотно-основными взаимодействиями имеется некоторая аналогия. [20]
Соединения рутения, проявляющие каталитические свойства в гомогенных редокс-реакциях, также действуют по механизму попеременного окисления-восстановления. [21]
Из двух изомеров - 1-аминоантрахинона и 2-аминиантрахинона - отчетливо выраженные редокс-реакции наблюдались только для первого изомера, который может ориентироваться параллельно плоскости поверхности. Это обеспечивает максимальную степень электронного взаимодействия и облегчает перенос электрона. [22]
Жидкий аммиак является прекрасным растворителем для проведения многих редокс-реакций. [23]
Приведенные рассуждения применимы, однако, только к редокс-реакциям с хорошо выраженной обратимостью. Вычисление константы равновесий теряет смысл, если реакция практически необратима, как, например, окисление железа ( II) перманганат-ионом в сернокислой среде. [24]
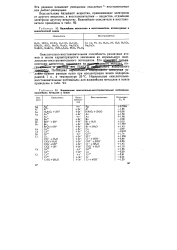 |
Важнейшие окислители и восстановители, используемые в аналитической химии.| Нормальные окислительно-восстановительные потенциалы важнейших металлов и ионов. [25] |
Эти реакции называют реакциями окисления - восстановления или редокс-реакциями. [26]
Это указывает на то, что в условиях эксперимента редокс-реакции метилвиологена протекают в диффузионном режиме. [27]
Таким образом, все выводы, полученные раньше для простых редокс-реакций, сохраняют свою силу и для реакции выделения водорода. [28]
Здесь рассмотрим поляризационные уравнения для простейших и близких к ним редокс-реакций. Особенности более сложных реакций обсуждены в разд. [29]
Эти флавины выполняют многообразные биологические функции: катализируют электронный перенос в редокс-реакциях аминов, спиртов и кислот; активируют молекулярный кислород и восстанавливают его в супероксид; переносят атомный кислород на субстрат и включают его в молекулу воды. Они участвуют и в других реакциях метаболизма углеводов, липидов и белков. [30]
Страницы: 1 2 3 4