Редокс-реакция
Cтраница 3
Стандартные потенциалы можно успешно использовать для определения значений активности, при которых редокс-реакция протекает в прямом или обратном направлении, а также условий, при которых в системе будет устанавливаться равновесие. [31]
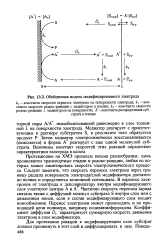 |
Обобщенная модель модифицированного электрода. [32] |
Протекающие на ХМЭ процессы весьма разнообразны; здесь проявляются транспортные стадии и редокс-реакции, любая из которых может лимитировать скорость электрохимического процесса. Следует заметить, что скорость переноса электрона через границу раздела поверхность электрода / слой модификатора достаточно велика и определяется величиной потенциала. Частично скорость переноса заряда связана также с диффузией молекул субстрата S внутри слоя или с движением ионов, если в состав модифицирующего слоя входит ионообменник. Перенос электронов может происходить и по проводящей цепи полимера, например поливинилферроцена. [33]
Для соединений Os ( VIII) также характерно увеличение каталитической активности в гомогенных редокс-реакциях при повышении щелочности растворов. [34]
Для реакций, протекающих на таких электродах, широко применяют термины окислительно-восстановительные реакции или редокс-реакции, хотя и они не очень удачны, так как реакции на реагирующих электродах тоже имеют окислительно-восстановительный характер. Реакции типа (1.31), связанные только с переходом одного электрона ( реже-с одновременным переходом двух электронов), далее будем называть простейшими редокс-реакциями, а реакции типа (1.32), в которых участвуют и другие компоненты раствора, - сложными редокс-реакциями. [35]
В некоторых случаях, изменяя концентрации ( активности) тех или иных ионов, редокс-реакции можно заставить протекать в направлении, обратном тому, которое соответствует стандартным окислительным потенциалам. [36]
Существует два типа ионных реакций: 1) реакция рекомбинации без изменения степени окисления частиц и 2) редокс-реакции с изменением степени окисления. [37]
В сильно кислых или щелочных средах определение затруднено вследствие высокой электропроводности системы, которая маскирует изменения электропроводности при протекании редокс-реакций. В тех случаях, когда редокс-реакция протекает с малой скоростью и продолжительность установления электропроводности после добавления каждой порции титранта велика, то такую реакцию использовать для титрования не представляется возможным. [38]
Кинетическое торможение не является исключительным свойством редокс-взаимодействий с участием кислорода, водорода и воды, скорее это характерная черта подавляющего числа редокс-реакций с участием как неорганических, так и особенно органических веществ. Даже для таких, относительно простых взаимодействий, как: [ Fe ( CN) e ] 3 - [ S2O3J2 -; Ce ( IV) Br -; I2 Ti ( III); Fe ( III) I - - константы скорости оказались весьма малыми [66], несмотря на то, что разность в значениях стандартных окислительных потенциалов составляет сотни милливольт. [39]
Ионы меди и серебра, а также другие катионы, обладающие двумя или более стабильными степенями окисления, транспортируют электроны в редокс-реакциях по цепному механизму, в котором металл-катализатор последовательно окисляется и восстанавливается. [40]
Указанные соединения выполняют роль медиаторов; сначала они принимают ( или отдают) электроны от электрода, а затем участвуют в быстрых редокс-реакциях с определяемым компонентом. Эти реакции широко используются в амперометрических ферментных биосенсорах, поскольку многие ферменты являются редокс-медиаторами. Разработаны способы иммобилизации хинонов, органических и неорганических ионов, редокс-красителей, ферментов. На сегодняшний день одним из лучших медиаторов является ферроцен - г - бис ( циклопентадиенил) железа. С электрохимической точки зрения ферроцен представляет собой классическую редокс-пару ( Е 165 мВ относительно НКЭ), на физические и химические свойства которой можно влиять, вводя заместитель в любое из колец молекулы. [41]
Исследования свойств поверхностных слоев на модифицированных электродах включают вопросы ковалентного и координационного привязывания, ориентации, величины поверхностного заполнения и толщины, редокс-реакций привязанных поверхностных групп и механизма транспорта электрона. [42]
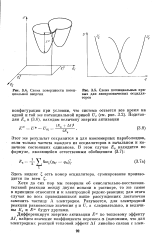 |
Схема поверхности потенциальной энергии.| Схема потенциальных кривых для ангармонических осцилляторов. [43] |
Хотя до сих пор мы говорили об окислительно-восстановительной реакции между двумя ионами в растворе, то же самое в принципе относится и к электродной редокс-реакции; для этого случая во всех приводившихся выше рассуждениях достаточно заменить частицу А электродом. Разумеется, для электродной реакции равновесные значения q и Е /, а следовательно, и величины Es и Е будут другими. [44]
Процесс передачи электрона в реакциях окисления-восстановления, катализируемых соединениями платиновых металлов, очень часто сопровождается образованием промежуточного соединения типа комплекса с переносом заряда между катализатором и одним из компонентов индикаторной редокс-реакции. Предполагается, что мостиком в таких промежуточных соединениях чаще всего служит гидроксильная группа. Так, в 1965 г. при исследовании каталитических свойств комплексных сульфатных соединений 1г ( 1П, IV) в реакции окисления церием () воды в сернокислой среде Гинзбург и Юзько [12] высказали предположение, что каталитической активностью обладают не сульфатные соединения иридия, а продукты их гидролиза. [45]
Страницы: 1 2 3 4