Редокс-электрод
Cтраница 2
 |
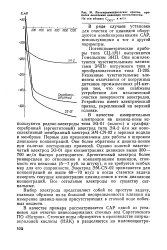
Потенциал на электродной системе ЭЗ-01 / ЭВП-08 при восстановлении хрома железным купоросом. [16] |
Следует отметить еще одну особенность применения редокс-электродов для контроля процесса восстановления хрома: поверхность этих электродов может покрываться продуктами как основных, так и побочных электрохимических реакций, осадками веществ, содержащихся в сточных водах. Вследствие этого электродная система теряет чувствительность и возникает проблема ее восстановления. Решать ее можно различными путями; чаще всего это делают периодической или непрерывной механической очисткой поверхности электродов или промывкой соответствующими растворителями. Для этого погружные промышленные датчики приборов на хром ( СХ-1М) снабжены механическим устройством - сеткой из капроновых нитей, которая совершает возвратно-поступательное движение и очищает поверхность электродов. Устройство приводится в действие портативным электроприводом, укрепленным на головке датчика. От различных замасливателей электроды очищают промывкой растворителями. [17]
Реакции второй группы изучают, используя так называемые редокс-электроды. В них применяют благородные металлы ( платин; иридий, золото и др.), а также графит, стеклоуглерод, стекла с эле. [18]
 |
Потенциометрическис кривые процесса окисления цианидов гипохлоритои. [19] |
В качестве измерительных электродов на цианид-ионы используются редокс-электроды типа ЭЗ-01 ( золото) и сульфид-серебряный ( аргентитовый) электрод типа ЭА-2 или же ионо-селективный мембранный электрод ЭМ-СМ-02 с зернами иодида в мембране. Первые два предназначены для работы в широком диапазоне концентраций. Они более обратимы к цианид-ионам при наличии посторонних примесей. Однако золотой пластинчатый электрод ЭЗ-01 при концентрациях цианидов выше 300 - 700 мг / л быстро растворяется. Аргентитовый электрод более универсален по отношению к концентрациям цианидов, стоимость его невысока ( 5 - 7 руб. за штуку), и не требуется особых мер для его сохранности. Электрод 3M - CN-02 применяется для концентраций не выше 60 - 70 мг / л и когда ставится задача измерять текущие концентрации цианид-ионов в этом диапазоне концентраций. Все остальные электроды по существу сигнальные. [20]
Измерительный электрод из металлического таллия относится к классу редокс-электродов. Электрохимическая реакция на электродах такого рода сводится к перемене валентности ионов таллия без изменения его состава. [21]
Большим преимуществом ионоселективного электрода ЭМ-CN-Ol по сравнению с редокс-электродами является возможность измерять текущие концентрации цианидов. Только сульфид-ионы, роданиды и некоторые органические вещества в наибольшей степени мешают измерять цианид-ионы мембранным электродом. [22]
Исследованы также другие пары сравнения со сходными характеристиками, например ферроцен-феррициниевый редокс-электрод. Используя несколько иной подход, Штрелов [27] определил стандартные свободные энергии переноса ионов щелочных металлов и галогенид-ионов из воды в метанол. Он сопоставлял энергии переноса галогени-дов щелочных металлов с уравнением Борна. [23]
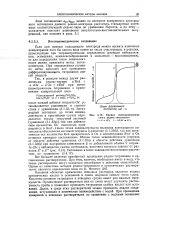 |
Кривая потенциометриче-ского редокс-титрования. [24] |
Зная соотношение a0x / aRed можно по величине измеренного электродного потенциала данного редокс-электрода рассчитать стандартный потенциал соответствующей редокс-пары по уравнению Нернста, а по нему - показатели констант равновесия окислительно-восстановительных полуреакций, как описано в разд. [25]
Зная соотношение a0x / flRed можно по величине измеренного электродного потенциала данного редокс-электрода рассчитать стандартный потенциал соответствующей редокс-пары по уравнению Нернста, а по нему - показатели констант равновесия окислительно-восстановительных полуреакций, как описано в разд. [26]
Зная соотношение flox / aRed можно по величине измеренного электродного потенциала данного редокс-электрода рассчитать стандартный потенциал соответствующей редокс-пары по уравнению Нернста, а по нему - показатели констант равновесия окислительно-восстановительных полуреакций, как описано в разд. [27]
Если в электродах на основе ионоселективных мембран чувствительным элементом является мембрана с избирательной проницаемостью, то редокс-электроды проявляют нернстовскую зависимость потенциала от отношения концентраций окисленных и восстановленных частиц в анализируемом растворе. Наиболее хорошо изучена глюкозоксидазная редокс-электродная система. Глюкозоксидазу иммобилизуют на платине, пористом графите или золоте. При погружении такого электрода в раствор глюкозы его потенциал линейно зависит от логарифма концентрации в диапазоне 50 - 400 мг / 100 мл, что представляет клинический интерес, поскольку нормальный уровень глюкозы в крови равен 90 - 120 мг / 100 мл. Источником потенцио-метрического сигнала в этом случае являются реакции окисления или восстановления функциональных групп на поверхности электрода пероксидом водорода, образующимся в катализируемом глюкозоксидазой процессе окисления глюкозы. [28]
При Gox aRed Уравнение ( VI 1 34) дает Е - Е0, следовательно, разность потенциалов между редокс-электродом и раствором, в котором активности окисленной и восстановленной форм данного вещества равны единице, называется нормальным окислительно-восстановительным потенциалом данной системы. Чем больше нормальный окислительно-восстановительный потенциал системы, тем больше активность окислителя в этой системе, тем, следовательно, в большей мере выражены ее окислительные свойства и наоборот. [29]
Электроды в зависимости от устройства и типа электродной реакции делятся на электроды первого рода, второго рода и окислительно-восстановительные, или редокс-электроды. [30]
Страницы: 1 2 3 4