Редоксит
Cтраница 3
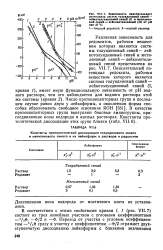 |
Зависимость окислительного ( о мВ потенциала систем толуидиаовый синий - 8 рН 10 г лейкотолуидиновый синий ( / и метилено-вый синий - лейкометиленовый ( II от рН. [31] |
Указанная зависимость для редокситов, рабочим веществом которых являются системы толуидиновый синий - лейкотолуидиновый синий и мети-леновый синий - лейкометиленовый синий представлена на рис. VII. В качестве протонакцепторных групп выступают боковые аминогруппы, присоединяющие ионы водорода в кислых растворах. [32]
Термодинамически реакционная способность редокситов определяется величиной их окислительно-восстановительного потенциала. Указывается [1], что подобно мономерным электрохимически активным веществам полимерные редокситы должны обладать окислительно-восстановительным потенциалом с общеизвестной нерн-стовской зависимостью его от величины рН и активности редокс-групп. [33]
Основываясь на свойстве редокситов быть электрохимически активными материалами, надо думать, что электрохимическая поляризация станет мощным рычагом управления окислительно-восстановительными процессами с их участием. [34]
Уменьшение размеров зерен редоксита приводит к закономерному росту количества поглощенного кислорода. Однако кинетические кривые для фракций с радиусом зерен, меньшим 0 12 мм, практически сливаются друг с другом. Это обстоятельство позволяет предположить, что для диффузии кислорода к поверхности слоя. [36]
Примем следующее определение редоксита [296]: редоксит - это фаза переменного состава, твердая или жидкая, которая вступает в обратимое окислительно-восстановительное взаимодействие с водными растворами окислительно-восстановительных систем. Обратимый обмен электронами происходит между двумя окислительно-восстановительными системами, одна из которых локализована в фазе редоксита, а другая - в водном растворе. [37]
Обратимость окислительно-восстановительного взаимодействия редокситов - это то свойство, которое непосредственно связано с их практической полезностью. Лишь для тех редокситов, для которых изменение емкости от цикла к циклу незначительно, возможно термодинамическое описание гетерогенных окислительно-восстановительных реакций. [38]
Зависимость окислительного потенциала редоксита от средней активности хлорной кислоты носит сложный характер [ уравнение (IX.16) ], поскольку [ С104 ] ( р) / [ HCIOJ, ( р), которая в свою очередь зависит от a ( HciOi) ( в) - В этой концентрационной области платина в совокупности с редокситом теряет свойства электрода, обратимого к перхлорат-аниону. [39]
 |
Кинетическая кривая восстановления ферро-ионов редокси-том ЭО-7 из 0 001 н. раствора на фоне 1 н. H2SO4.| Спектры ЭПР двухвалентной меди, образующейся при окислении редоксита 0 01 н. раствором. [40] |
Методика работы с редокситами в динамических условиях в принципе не отличается от работы с ионитами. [41]
Взаимодействие окислителей с редокситами происходит не только путем основного окислительно-восстановительного превращения активных групп полимера, но и за счет дополнительного необратимого окисления органической матрицы. Степень деструктивных изменений зависит от конкретного выбора редокс-систем и условий их действия. [42]
Исследование скорости поглощения редокситами окислителей ( или восстановителей), растворенных в жидкой фазе, проводится путем химического анализа раствора или редоксита. [43]
Протолитические процессы в редоксите вызываются изменением рН водного раствора. [44]
По мере проникновения в редоксит окислитель поглощается на равномерно распределенных группах, а зона реакции перемещается вглубь редоксита. Тогда математическая задача описания этого процесса в общем виде формулируется следующим образом. [45]
Страницы: 1 2 3 4
