Кинетический режим
Cтраница 2
В кинетическом режиме длина зоны реакции по-прежнему обратно пропорциональна величине давления газа; в диффузионном она остается неизменной при увеличении давления. С увеличением объемной концентрации v0 длина зоны сокращается. [16]
В кинетическом режиме на характер изменения зависимости длины зоны горения от коэффициента избытка воздуха влияет также химическая характеристика топлива. [17]
В кинетическом режиме скорость реакции в общем случае описывается уравнением W - koSf ( C), где fto - удельная ( отнесенная к единице поверхности) константа скорости, S - величина поверхности катализатора. Интенсивность барботажа газа или механического перемешивания не влияет на скорость реакции. [18]
При кинетическом режиме ток 1кан зависит от угловой скорости, так как с ростом частоты / растет индуктивное сопротивление обмоток; поэтому пользование формулой ( 1 - 456) неудобно. [19]
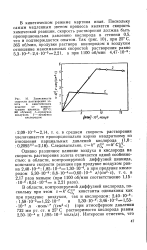 |
Зависимость скорости растворения золота в кинетическом режиме от концентрации цианида ( 25 С. 365 об / мин. / - продувка воздухом. 2 - продувка кислородом. [20] |
В кинетическом режиме картина иная. Поскольку самым медленным звеном процесса является скорость химической реакции, скорость растворения должка быть пропорциональна давлению кислорода в степени 0 5, что и подтверждается опытом. [21]
В кинетическом режиме влияние температуры на скорость растворения золота иное. [22]
В кинетическом режиме с реакцией в объеме фаз скорость экстракции не зависит ни от интенсивности перемешивания, ни от поверхности раздела фаз. Это объясняется тем, что скорость массопередачи так велика, что фазы практически находятся в равновесии по отношению к соединению, переходящему из одной фазы в другую. [23]
 |
Результаты опытов по инициированному окислению топлива Т-6 с молибденом и дисульфидом молибдена. [24] |
При кинетическом режиме все определяет скорость реакции RCV с поверхностью. В этом случае скорость обрыва цепей vt ksS [ R O2 - ], где ks - константа скорости реакции пероксидных радикалов с поверхностью. [25]
В кинетическом режиме в случае поверхностной реакции скорость экстракции не зависит от скорости. X ], и [ X v - концентрации в поверхностном слое и объеме; а - коэффициент, значение которого зависит от способа выражения концентраций. [26]
В кинетическом режиме скорость окисления практически не зависит от притока кислорода извне; процесс поддерживается вступающим в реакцию кислородом, который адсорбирован на поверхности частиц. В этом режиме может быть достигнута температура, при которой начинается тление материала. [27]
В кинетическом режиме, как указывает В.Н.Кондратьев [70], концентрации активных центров в объеме п и у поверхности п практически равны: п щ эффективная константа скорости процесса К и константа скорости реакции К также равны, поэтому суммарная скорость реакции if описывается зависимостью. [28]
 |
Зависимость состава реакционной массы при необратимом ( а и обратимом ( б алкилировании бензола от соотношения исходных реагентов. [29] |
При кинетическом режиме процесса, поскольку вторая стадия алкилирования протекает быстрее первой, при k2 / k ( 1 2 Ч - 2 0) максимальное содержание моноалкилбензола в смеси составляет только 25 - 30 % ( мол. [30]
Страницы: 1 2 3 4