Значение - число - перенос
Cтраница 1
Значения чисел переноса через катионитовые мембраны приведены для иона натрия, через аннонитовые - для иона хлора. [1]
Значения чисел переноса, полученные по методу движущейся границы, являются, повидимому, более надежными. [2]
 |
Схема электролитической ячейки для определения чисел переноса. [3] |
Значение чисел переноса важно для выяснения природы ионов и механизма переноса тока. Определение их значений удобно проводить с использованием радиоактивных индикаторов. Эксперимент может быть выполнен следующим образом. [4]
Постоянство значений числа переноса при изменении тока на 50 % является обязательным критерием правильности измерений. [5]
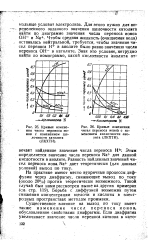 |
Кривые измене-ния чисел перйноса ионов с изменением щелочности католита ( ЛКХТИ.| Кривые изменения чисел переноса ионов с изменением кислотности ано-лита ( ЛКХТИ. [6] |
Этим определяется значение числа переноса Na для данной кислотности в анолите. Разность найденных значений чисел переноса иона Na дает теоретически ( для данных условий) выход по току. [7]
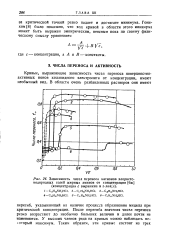 |
Зависимость чисел переноса катионов хлористо. [8] |
После перегиба значения чисел переноса резко возрастают до необычно больших величин и далее почти не изменяются. [9]
 |
Схема расчета теоретического значения выхода по току при электродиализе ( с электрохимически неактивными мембранами. [10] |
Вычисленную из значений чисел переноса ионов величину выхода по току обычно принято называть истинным выходомпотоку. [11]
В табл. 2 дана сводка значений чисел переноса в твердых солях. Абсолютные значения чисел переноса для одной и той же соли, приводимые разными исследователями, не всегда хорошо согласуются между собой. Как ясно показано Керкгофом [12] на примере КС1, это происходит в основном из-за различия в чистоте соли. Значение таблицы, однако, состоит в выявляющейся качественной закономерности. Галогениды в основном представляют собой чисто ионные проводники, тогда как многие сульфиды и окислы ( например, a - Ag2S, PbS, NiO, Cu2O, Fe3O4) являются электронными проводниками. Тенденция окислов и сульфидов к проявлению электронной проводимости связана с наблюдаемыми для них отклонениями от стехиометрии ( см. стр. Галогениды меди представляют исключение, так как в области температур 0 - 400 их проводимость полностью переходит из электронной в катионную. Галогениды щелочных металлов, относящиеся к чисто ионным проводникам, при низких температурах обладают 100 % - ной катионной проводимостью, но при повышении температуры, когда потенциальные барьеры для движения ионов всех типов уменьшаются, начинает проявляться также анионная проводимость. Чем чище галогениды щелочных металлов, тем ниже температура, при которой становится заметной эта биполярная проводимость. [12]
Деление уравнения (III.31) на (III.23) дает значение числа переноса иона, отличного оттого, относительно которого обратимы крайние электроды. [13]
Подвижность ионов может быть подсчитана из электропроводности, значений чисел переноса и концентрации. [14]
Иногда при увеличении концентрации раствора наблюдаются необычные зависимости и получаются значения чисел переноса, на первый взгляд, не имеющие физического смысла - отрицательные или больше единицы. Это характерно для растворов, в которых ионы склонны к образованию комплексных соединений или продуктов ассоциации с другими ионами либо молекулами. Он дал правильное объяснение этому наблюдению, указав, что при увеличении концентрации по реакции Cd2 - j - 4I -: CdJ42 - образуются комплексные анионы, содержащие кадмий. Эти анионы переносят кадмий не к катоду, а к аноду, что искажает результаты измерений. Аналогичные эффекты наблюдаются в растворах слабых электролитов, например, слабых кислот НА, в которых возможно образование ассоциатов типа А - - - НА, а в результате наблюдается дополнительный перенос молекул НА к аноду. [15]
Страницы: 1 2 3