Значение - число - перенос
Cтраница 2
Очевидно, что эффект короткого замыкания тем больше, чем меньше значение числа переноса электронов te и выше сопротивление окалины. [16]
Концентрационная поляризация на поверхности ионообменных мембран, возникающая в результате различия значений чисел переноса ионов в фазах мембраны и раствора, приводит к увеличению омического сопротивления камер деионизации за счет снижения концентрации в прилегающем к мембране слое и вызывает перенос ионов Н и ОН, что снижает выход по току и способствует выпадению осадков на поверхности мембран. [17]
Следовательно, из измерений разности потенциалов такого рода электрохимических ячеек можно получить значения чисел переноса, однако следует заметить, что метод Гитторфа дает более точные результаты. [18]
Чтобы средняя жидкость ( очищаемая вода) оставалась нейтральной, требуется, чтобы значение чисел переноса Н в анолите было равно значению числа переноса ОН - в католите. [19]
Если скорость границы меняется, то по ходу опыта будет получаться последовательно увеличивающееся или уменьшающееся значение числа переноса. К счастью, наибольшее количество факторов, искажающих скорости границы, зависит от силы тока, и наличие ошибок легко выявить. [20]
Чтобы средняя жидкость ( очищаемая вода) оставалась нейтральной, требуется, чтобы значение чисел переноса Н в анолите было равно значению числа переноса ОН - в католите. [21]
Из результатов измерения чисел переноса разбавленных растворов КВг в метаноле и KCNS в метаноле и этаноле при 25 Смиско и Доусон вычислили значения чисел переноса катиона при бесконечном разбавлении для КВг и KCNS в этих растворителях. [22]
Повышение температуры электролиза вполне целесообразно, так как при этом увеличивается удельная электропроводность электролита, уменьшается растворимость хлора в анолите и повышаются значения чисел переноса катионов. В конечном счете повышение температуры в электролизере приводит к снижению напряжения и повышению выхода по току. Поэтому, несмотря на увеличение скорости коррозионных процессов, в частности износа графитовых анодов, стремятся вести электролиз при повышенной температуре. [23]
В некотором отношении аналогичным образом число переноса ионов водорода изменяется при добавлении к раствору гликоля и глицерина ( рис. 4.35 и 4.36), однако спад значений числа переноса не столь значителен. [24]
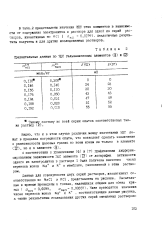 |
Сравнительные данные по ЭДС гальванических элементов ( Щ и. [25] |
В соответствии с уравнениями ( 6) и ( 7) графическим дифференцированием зависимости ЭДС элемента ( 1У) от логарифма активности одного из электролитов в растворе I были получены значения чисел переноса ионов N а и К в мембране, равновесной с этим раствором. [26]
Видно, что относительная разность подвижностей каждого из катионов в расплаве больше, чем в водном растворе. Поскольку значения чисел переноса катионов в первом случае также больше, чем во втором [496, 499], можно заключить, что при прочих равных условиях эффективность обогащения изотопов в расплавах должна быть выше, нежели в водных растворах соответствующих солей. [27]
Как показано в разд. Кроме того, значения чисел переноса полезны и для других расчетов. [28]
Числа переноса ионов фтора и хлора в водных растворах KF и КС1 при добавлении небольших количеств метанола, этанола, пропанола, этиленгликоля и глицерина уменьшаются ( рис. 4.22), достигают минимальных значений в растворах с содержанием неэлектролита 10 - 20 мол. В растворах, содержащих метанол [23], минимум значений чисел переноса очень широкий, но в растворах с этанолом [24] кривая значений проходит максимум при концентрации этанола примерно 50 мол. [29]
Полученные значения химических коэффициентов активности [107-110] автор называет условными, указывая, что они существенно зависят от правильности расчета соответствующих диффузионных потенциалов. Вместе с тем из текста рассматриваемых публикаций неясно, какие значения чисел переноса использованы при расчете по уравнению Гендерсона - соответствующие бесконечному разбавлению электролита или его реальным концентрациям; это особенно важно в случае таких электролитов, как LiCl, MgCU, СаСЬ, для которых числа переноса составляющих их ионов существенно зависят от концентрации раствора. Неясно также, во всех ли случаях способ формирования жидкостной границы соответствовал условиям применимости уравнения Гендерсона. [30]
Страницы: 1 2 3