Значение - число - перенос
Cтраница 3
Рассчитываем выход по току. Вообще, выход по току в таком процессе определяется разностью значений чисел переноса катионов в катодном и анодном пространствах и разностью чисел переноса анионов в анодном и катодном пространствах. На рис. 25 и 26 показаны рассчитанные нами числа переноса для ионов Н, ОН -, Na, Cl - и SO4 в зависимости от кислотности и щелочности среды. [31]
При использовании электрохимически активных мембран возможно изменение концентрации растворов в средней камере и в том случае, когда во всех трех камерах электродиализатора находится раствор одного и того же электролита. Было установлено, что изменение концентрации раствора при электродиализе зависит только от значений чисел переноса ионов в мембране и не зависит от чисел переноса ионов в свободном растворе. [32]
Особое внимание в книге уделено изложению отдельных электрохимических вопросов, имеющих фундаментальное значение, но часто нечетко или даже неправильно трактующихся в книгах и учебниках. К их числу относятся такие, на первый взгляд элементарные, вопросы, как механизм прохождения электрического тока через раствор электролита, природа электродного потенциала, значения чисел переноса в диффузионном слое и другие. [33]
Во многих представляющих интерес ячейках мембрана занимает всю область контакта или ее часть. Для определения изменений электрохимических потенциалов по мембране по-прежнему можно использовать уравнение ( 16 - 1), хотя в области изменения химических потенциалов может существовать некоторая неопределенность в значениях чисел переноса. [34]
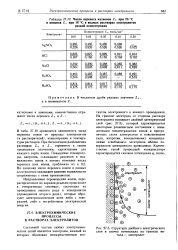 |
Число переноса катионов Z при 25 С.| Структура двойного электрического слоя и скачок потенциала на границе металл - электролит. [35] |
В табл. 27.10 приводится зависимость чисел переноса ионов от природы электролитов ( и растворителей), концентрации и температуры растворов. При бесконечном разбавлении растворов Z и Z стремятся к своим предельным значениям, характерным для каждого сорта ионов. На значения чисел переноса ионов в разных электролитах оказывают влияние подвижности сопряженных с ними противоионов. [36]
Преимущество этой разновидности метода состоит в том, что здесь можно использовать только один вид обратимого электрода. Однако для этого метода должны быть известны значения чисел переноса для ионов данного электролита в исследуемом интервале концентраций. [37]
При электролизе перемещение ионов в расплавленных солях приобретает направленный характер - катионы перемещаются к катоду, а анионы к аноду. Доля участия в переносе тока каждого вида ионов определяется значениями чисел переноса ионов и, следовательно, их подвижностью, а возможность разряда на электродах - потенциалами этих ионов. Чем больше величина положительного потенциала иона, тем более вероятен ( при прочих равных условиях) его разряд на котоде. С другой стороны, разряд иона с большим отрицательным потенциалом более вероятен на аноде. Доля участия ионов в переносе тока к электродам зависит также от заряда и концентрации данного вида ионов: чем она выше, тем больше тока переносится этими ионами. [38]
Рассмотренные объемные и весовые способы определения чисел переноса ионов основаны на исключении потока расплавленной соли через диафрагму, вызванного гравитационными силами. Так как в начальный момент времени, в пределе при т - - 0, величина потока также стремится к нулю, значения чисел переноса можно рассчитать из начального наклона кривых Д / г р ( т) или ДР1 ( т), где А / г - разность уровней расплава в электродных пространствах ячейки; а АР - разница в весе вещества катодного и анодного отделений электролизера. Электролиз проводится при постоянной величине тока и с обратимыми электродами. [39]
После достижения максимального значения числа переноса дальнейшее повышение концентрации одноатомных спиртов приводит к заметному уменьшению числа переноса ионов водорода. Его значения достигают минимума в интервале концентрации спиртов 90 - 95 мол. Таким образом, проводимость по прототропному механизму в этих условиях падает. В растворах с метанолом и этанолом минимальные значения числа переноса ионов водорода составляют ts 0 558 и 0 567 соответственно. Следовательно, в этих растворах доля прототропной проводимости в переносе электричества должна быть невысокой. Необходимо отметить, что последовательность минимумов чисел переноса не совпадает с порядком изменения молекулярных масс спиртов. Увеличение числа переноса после минимума связано, вероятно, с прототропной проводимостью через молекулы спирта. Однако число переноса ионов водорода в чистых одноатомных спиртах не достигает значения числа переноса в чистой воде. [40]
Страницы: 1 2 3