Значение - энергия - электрон
Cтраница 4
Предположим, что рассматривается энергия электрона в атоме. Дискретному набору значений энергии электрона соответствует система так называемых энергетических уровней. Электрон может перейти на другой энергетический уровень 2.1 ( уровень ЕЪ или какой-то другой), получив или испустив соответствующее количество энергии. Такой переход называется квантовым перекодом. [46]
Серия точек по вертикали также хорошо описывала бы энергетический спектр. Ордината соответствует значениям энергии электрона в подходящей системе единиц. На фигуре показана вторая верхняя серия энергетических уровней, соответствующих возможным, но не обязательно реализующимся значениям энергии. Этот набор энергетических уровней, или, как его иногда называют, ансамбль энергетических уровней, и составляет зону. Эта зона называется зоной проводимости, что указывает на тот факт, что в случае германия, например, электроны на энергетических уровнях, попадающие в эту зону, и есть те электроны, которые принимают участие в процессе проводимости, являясь носителями электрического тока. Ниже этой зоны проводимости имеется заполненная полоса, отделенная запрещенным участком. [47]
Аналитическая сущность этого закона проста. Известно, что значения энергий электронов в атоме индивидуальны для каждого элемента. Поэтому, если для возбуждения фотоэмиссии использовать монохроматическое рентгеновское излучение, то кинетические энергии фотоэлектронов окажутся характеристичными. [48]
Каждый электрон в молекуле описывается с помощью определенной волновой функции ср, которую называют молекулярной орбиталью. Полная электронная энергия молекулы равна сумме значений энергии электронов на всех занятых молекулярных орбиталях. [49]
Основное уравнение квантовой механики - волновое уравнение Шредингера ( 1926), решениями которого являются так называемые волновые функции г з ( пси), характеризующие состояние электрона в атоме. Из математического анализа уравнения вытекает дискретность значений энергии электрона, момента количества его орбитального движения ( в силовом поле ядра) и проекции этого момента на выделенное в пространстве направление. [50]
 |
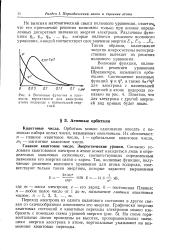
Схема уровней энергии и квантовые переходы электрона в атоме. [51] |
Графически энергию квантовых состояний электрона в атоме водорода можно изобразить при помощи уровней энергии. На рис. И горизонтальные линии соответствуют значениям энергии электрона в атоме водорода. Энергия связи электрона с ядром оценивается количеством энергии, необходимой для его удаления от ядра на бесконечное расстояние. Поэтому значения энергии электрона указываются со знаком минус. На ближайшем к ядру энергетическом уровне энергия электрона минимальна. [52]
Физическая природа делокализованных состояний, аналогичных реализующимся в неупорядоченных полупроводниках и диэлектриках, во многих отношениях подобна природе состояний электронов проводимости. Модельные расчеты показывают, что существует такое значение энергии электрона, выше которого реализуются делокализованные, а ниже - локализованные состояния. [53]
Число, которое определяет величину энергии в атоме и, как увидим дальше, является важной характеристикой электронного облака, называется главным квантовым числом. Таким образом, основной вывод теории Бора о дискретности значений энергии электрона в атоме вытекает как следствие из квантовой механики. [54]
Графически энергию квантовых состояний и квантовые переходы электронов можно изобразить с помощью схемы уровней энергии, как это показано на рис. 1 для электрона атома водорода. На схеме горизонтальные линии проведены на высотах, пропорциональных значениям энергии электрона в атоме, вертикальные указывают на возможные квантовые переходы. [55]
 |
Волновые функпии и плотность вероятности для электрона атома водорода с наименьшей энергией. [56] |
Переход электрона из одного квантового состояния в другое связан со скачкообразным изменением его энергии. На схеме горизонтальные линии проведены на высотах, пропорциональных значениям энергии электрона в атоме, вертикальные указывают на возможные квантовые переходы. [57]
Страницы: 1 2 3 4