Резонанс - ядро
Cтраница 1
Резонанс ядра в атоме наступает в области более высоких полей, чем резонанс ядра, полностью лишенного электронной оболочки. Поскольку не существует ядер без электронов, на практике для сравнения используют стандартные вещества, относительно которых измеряют химический сдвиг. [1]
Рассмотрим резонанс ядер А. [2]
 |
Спектр хлорэтана.| Спектр ЯМР уксусного альдегида. [3] |
Теперь рассмотрим резонанс ядра атома Я. [4]
Что касается резонанса ядер Б, то форма их сигнала связана с тем, что они видят ядра А в восьми равновероятных состояниях: 1) оста, 2) осф, 3) PCKZ, 4) офр, 5) офз, 6) Роф, 7) ppz, 8) ррр. В результате сигнал группы Б представляет собой квартет с соотношением интенсивностей 1: 3: 3: 1, с расстояниями между компонентами, равными / ДБ. При этом соотношение суммарных интенсивностей сигналов А и Б составляет 3: 2, в соответствии с количеством ядер в этих группах. [5]
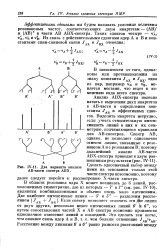 |
Два варианта анализа АВ-яасти спектра АВХ. [6] |
В области резонанса ядра X может возникать до 6 линий, расположенных симметрично, две из которых - Т и 7 ( см. рис. IV-10), являются комбинационными и обычно очень мало интенсивны. Две наиболее интенсивные линии - 5 и 5 - разделены расстоянием j / дт - Ь - - кх. Если спектр позволяет отличить эти Д е линии от двух других, несколько менее интенсивных линий 6 и 6, то путем сопоставления частей X и АВ спектра возможно произвести однозначное отнесение линий в последней. [7]
Обнаружены характеристические сдвиги резонанса ядер 13С в орто -, мета - и пара-положениях, которые хорошо коррели-руются с электроноакцепторной силой заместителя. [8]
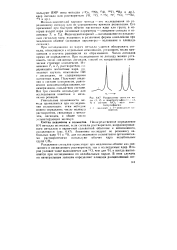 |
Расщепление сигналов воды ( /. 2 и диметилсу. чьфокси и ( J, 1 в системе А1С13 вод. димг. [9] |
Акваионы исследуют по резонансу лабильных ядер Н и 7О, для исследования сольватации органическими растворителями используют обычно ядра нелабильных групп СНП. [10]
Хе и константу взаимодействия Хе-F; однако резонанс ядер ксенона с трудом поддается измерению. Эти данные очень трудно интерпретировать в терминах параметров, характеризующих электронное строение; поэтому предпринимались попытки провести лишь качественные сравнения. По-видимому, степень ионности атомов фтора во фторидах ксенона сравнима со степенью ионности фтора в молекуле HF, однако важно отметить, что на измеряемую величину химического сдвига может влиять не только степень ионности, но и гибридизация. [11]
Вертикальными линиями отмечены переходы, связанные с резонансом ядра А; линии, наклоненные влево, связаны с переходами ядра В, а вправо - с переходами ядра С. Три штриховые линии соответствуют трем комбинационным переходам. Стационарные состояния, так же как и переходы, обычно выражают в герцах. [12]
Следовательно, для того чтобы данная частота вызывала резонанс ядер в различных структурных окружениях, необходимы поля, отличающиеся от Н0 и друг от друга. [13]
В этом случае можно зарегистрировать две отдельные линии резонанса ядер О17, которыми обогащена вода, принадлежащие свободной и связанной воде. Но изменению сдвигов в зависимости от концентраций парамагнитных и диамагнитных ионов определены координационные числа гидратации некоторых ионов в растворе. [14]
В этом случае можно зарегистрировать дв отдельные линии резонанса ядер О17, которыми обогащена вода принадлежащие свободной и связанной воде. По изменению сдвипл в зависимости от концентраций парамагнитных и диамагнитных пошл определены координационные числа гидратации некоторых ионот в растворе. Эти цифры блестяще совпадают с общепринятыми. Если учесть, что они получены без грубых допущений, потребовавшихся при расчете nh из данных по химическим сдвигам протонов воды, [111], станет ясной необходимость развития исследований растворов в этом направлении. [15]
Страницы: 1 2 3 4