Диметилкадмий
Cтраница 2
Реакция между дигидридом дифенилолова и комплексами диметилкадмия проходит более сложно. Например, в диметоксиэтане выделяется лишь небольшое количество газа и образуется металлический кадмий. [16]
Совершенно прозрачный дистиллят, состоящий из диметилкадмия с примесью эфира, путем перегонки в токе азота почти полностью освобождают от эфира, а остаток медленно перегоняют на колонке при атмосферном давлении с масляной баней. После отгонки небольшой предварительной фракции температура кипения быстро достигает 105 2 С. [17]
В ряде работ [10, 9.1-95] описывается действие диметилкадмия на хлорангидриды различных алкоксикислот. [18]
В растворителе, содержащем растворенный кислород, диметилкадмий медленно окисляется уже при комнатной температуре; при 50 С реакция протекает быстрее и образуется белая, твердая взрывчатая перекись, состав которой не изучался. Как и в случае перекисей, содержащих бор, нуклеофильная миграция алкильной группы от металла к кислороду происходит легко, особенно при нагревании. [19]
Наличие заместителей в бензольном кольце не меняет характера взаимодействия диметилкадмия с хлорангидридами кислот. Описано [44], правда, без указания выхода, получение 3-метил - 3 ( п-нитрофе-нил) бутанона-2 при действии диметилкадмия на хлорангидрид а - ( - нитрофенил) изомасляной кислоты. [20]
Гидрид кадмия СсШз был получен действием эфирного раствора LiAlH4 на диметилкадмий [124] или раствор солей кадмия. По данным Виберга и Хенле [637], при действии избытка эфирного раствора LiAlH4 ( при - 70 - 40) на раствор Cdb в тетрагидрофуране получается объемистый осадок гидрида кадмия. [21]
Исследовано равновесие жидкость - пар разбавленных растворов диметил - и диэтилцинка, диметилкадмия и тетра-метилолова в триметилгаллии. Показано, что исследованные системы хорошо описываются теорией свободного объема. [22]
Хотя на бумаге этот путь кажется более сложным, чем реакция с диметилкадмием ( разд. [23]
Дэвис и Паккер [90] отметили, что следы пиридина сильно катализируют поглощение кислорода растворами диметилкадмия в цик-логексане. Скорость 5н2 - реакции у атома кадмия непрерывно возрастала до прибавления одного молярного эквивалента пиридина, а при дальнейшем повышении концентрации пиридина скорость реакции уменьшалась. В общем пока металл не стал координационно насыщенным, добавление ли-ганда может или увеличивать или уменьшать легкость гемолитического замещения у атома металла в зависимости от специфики реакции. [24]
Девис и Паркер [4, 5] специально изучали окисление кадмийорганических соединений кислородом воздуха и нашли, что диметилкадмий на воздухе адсорбирует кислород, давая стеклообразную массу, которая при прикосновении взрывается. В циклогексане диметилкадмий при комнатной температуре медленно адсорбирует приблизительно эквивалентное количество кислорода, давая перекись. Присутствие следов пиридина катализирует эту реакцию, окисление в эфире протекает медленно, в анизоле - быстрее. Диэтил - и дибутилкадмий гораздо более реакционноспособны: они присоединяют в эфире на каждую молекулу соединения две молекулы кислорода, причем авторам удалось раздельно выделить вещества после поглощения одной или двух молекул кислорода. [25]
По методу, предложенному С. Д. Барбаросом и сотрудниками [2], гидрид кадмия получают взаимодействием литийалюминийгидрида с диметилкадмием в эфирном растворе. [26]
К этому раствору при - 65 С в течение 1 часа прибавляют 7 1 г ( 50 ммолей) диметилкадмия в 20 мл тетрагидрофурана, реакционную смесь перемешивают еще 1 час при той же температуре. Часть тетрагидрофурана отгоняют в вакууме при 25 С. Остаток обрабатывают водой, водный слой экстрагируют эфиром, от соединенных вытяжек отгоняют растворитель, остаток перегоняют. Получают 5 9 г ( 51 %) этилового эфира пировиноградной кислоты. [27]
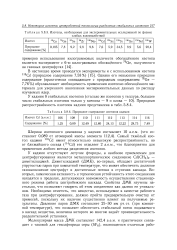 |
Изотопы, необходимые для экспериментальных исследований по физике.| Природное содержание изотопов кадмия. [28] |
У кадмия отсутствуют летучие фториды, а наиболее приемлемым для центрифугирования является металлоорганическое соединение Cd ( CH3) 2 - диметилкадмий. Диметилкадмий ( ДМК), во-первых, обладает достаточной упругостью паров при комнатной температуре, что может обеспечить должное газонаполнение центрифуг и достаточные потоки в ступенях каскада. Во-вторых, химическая активность и термическая устойчивость этого соединения находятся в пределах, допускающих возможность осуществления стационарного режима работы центробежного каскада. Свойства ДМК изучены настолько, что позволяют говорить об этом соединении как далеко не уникальном. Необходимо отметить, что вещество, используемое в качестве рабочего газа при центрифугировании, должно пройти предварительную очистку от примесей, поскольку их наличие существенно влияет на получаемые результаты. Давление паров ДМК составляет 25 - 30 мм рт. ст. ( при комнатной температуре), что позволяет обеспечить стабильный поток подаваемого в каскад вещества, величина которого во многом задает производительность разделительной установки. [29]
Имеются указания [20], что 2-ацетил - З - бензойная кислота была приготовлена с выходом 53 % при медленном прибавлении тонкоизмельченного 3-нитрофталевого ангидрида к диметилкадмию. [30]
Страницы: 1 2 3 4