Кинетический результат
Cтраница 1
Кинетические результаты обычно выражают в терминах концентрации реагентов. Это не представляет трудностей, если кислотно или основно катализируемые реакции изучают в присутствии известных концентраций добавленной кислоты или иона гидроксила. Однако измерения скорости с применением для определения концентрации кислоты или основания значений рН приводят к константам скорости для кислотно или основно катализируемых реакций, основанным на активностях, а не на концентрациях реагентов. [1]
Кинетические результаты позволили предположить, что механизм замещения включает первоначальную бимолекулярную реакцию никелевого комплекса с фосфитом, приводящую к промежуточному продукту [ DQNi ( ofle - фин) Р ( ОВ) 3 ], в котором олефин монодентатен. Этот промежуточный продукт претерпевает либо мономолекулярное отщепление олефина с образованием координационно-ненасыщенного соединения DQNiP ( OR) 3, либо бимолекулярную реакцию с фосфитом с образованием DQNi [ P ( OR) 3 ] 2 и олефина. Последующее превращение DQNi [ P ( OR) 3 ] 2 в Ni [ P ( OR) 3 ] 4 протекает быстро и не влияет на общую скорость замещения. [2]
Кинетические результаты этих экспериментов впоследствии подтверждены с помощью той же торцевой методики, но уже в смесях без добавок СО. [3]
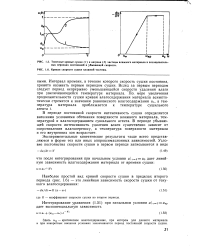 |
Типичные кривые сушки ( / и нагрева ( 2 частицы влажного материала в последовательных периодах постоянной и убывающей скорости.| Кривая скорости сушки влажной частицы. [4] |
Экспериментальные кинетические результаты чаще всего представляются в форме тех или иных аппроксимационных зависимостей. [5]
Рассмотренные кинетические результаты, а также характер влияния заместителей на скорость реакции и структура полученных продуктов позволяют предположить для данной реакции механизм бимолекулярного замещения аминогруппой анилина углеродного атома в трехчленном кольце О-этил - N N-этилен-уретана. [6]
Кинетический результат восстановления кетонов контролируется эффективным объемом восстановителя и конформацией восстанавливаемого соединения, в то время как состав конечных продуктов реакции определяется также отно - сительной термодинамической стабильностью образующихся изомеров. Количество аксиальных изомеров увеличивается с ростом объема молекулы восстановителя. [7]
Однако прлучен-ные кинетические результаты позволяют исключить из рассмотрения механизм инактивации IV, согласно которому фермент ина-ктивируется конечным продуктом реакции: - одной из образующихся перекисей. [9]
Обработка кинетических результатов по уравнению ( 1) показала, что экспериментальные точки хорошо ложились на прямые. Можно предположить, что реакции с образованием эфира или бутена протекают параллельно и независимо друг от друга. [10]
Сопоставление кинетических результатов показывает, что с увеличением катионной плотности в цеолите активность в дегидратации с образованием эфира практически линейно увеличивается в ряду натриевых форм. [11]
Интерпретация кинетических результатов, полученных Поспишилом и Де Леви [97], осложнялась тем, что были исследованы достаточно концентрированные по отношению к 5СМ - - ионам растворы. Тем не менее данные Поспишила и Де Леви [97, 98] показывают, что взаимодействие между ионами 1п3 и 8СМГДС более сложно, чем бимолекулярная реакция, и приводят к предположению о наличии здесь параллельных гете-рогенно-поверхностных реакций. [12]
Интерпретация кинетических результатов, как это следует из вида полученных выше математических выражений, чрезвычайно осложнена существованием градиентов для различных компонент смеси. Даже если известны законы изменения реакционной поверхности раздела [ уравнение (4.2) ] и законы ее продвижения [ уравнение (4.3) ], то и в этом случае математическое описание представляет собой трудную задачу. В большинстве случаев для решения задачи приходится использовать мощные вычислительные машины. Совершенно напрасны, вероятно, попытки уточнить форму уравнений (4.2) или (4.3) путем анализа экспериментальных данных, так как для этого необходимо было бы сравнить экспериментальные результаты с огромным количеством интегрируемых функций, взятых в различных комбинациях со всеми возможными предположениями относительно рас сматриваемых соотношений. [13]
Этот и подобные кинетические результаты из области моделирования вселяют в нас уверенность, что основные закономерности ферментативного катализа поняты правильно. [14]
Ваше объяснение кинетических результатов при высоких температурах ( 210) базируется на предположении, что водород полностью покрывает 5-центры. В то же время в случае кинетических результатов, полученных при низких температурах ( 162), используется предположение об умеренном покрытии. Оригинальное объяснение, предложенное Швабом, как Вы знаете, основано на предположении о малой величине покрытия ж приводит к уравнению кинетики второго порядка. [15]
Страницы: 1 2 3 4