Диметилциклопентана
Cтраница 2
Реакция каталитической дегидрогенизации нафтенов была проверена Фрайесом [61] при помощи меченых атомов. На установке, производившей толуол из смеси метилцикло-гексана, диметилциклопентана и - гептана ( на алюмомолиб-деновом катализаторе) был применен метилциклогексан, меченый радиоактивным углеродом - С14 в метильной группе. Оказалось, что только половина толуола образовалась из метилциклогексана. Вторая половина могла образоваться только из диметилциклопентана, ибо катализатор не действовал в направлении превращения гептана в толуол. [16]
Толуол также может быть получен из экстрактов ароматизированных, подвергнутых риформингу фракций нефти. В процессах риформинга он образуется в основном ароматизацией метилцикло-гексана и диметилциклопентана. В последнем случае одновременно происходит расширение цикла. [17]
Если риформинг проводится для получения бензола и толуола, сырьем служат узкие бензиновые фракции, выкипающие в пределах 62 - 85 и 85 - 105 С соответственно. В первой из них бензол образуется из цикло-гексана, метилциклопентана и н-гексана, во второй фракции толуол образуется из метилциклогексана, диметилциклопентана и н-гептана. [18]
Авторы считают, что образование ароматических углеводородов из таких алифатических углеводородов, которые не могут без предварительной изомеризации углеродного скелета дать ароматику ( например, из замещенных пентанов или из таких замещенных гексанов, которые имеют четвертичный атом углерода), протекает через стадию замыкания 5-членного цикла с последующей изомеризацией все еще адсорбированной молекулы в гомолог циклогексана. В качестве подтверждения этой точки зрения ими приводятся данные, согласно которым на одном и том же образце катализатора ( окись хрома на окиси алюминия) при 550 был получен катализат, содержащий 30 % толуола в случае 2.3 - диметилпентана, 20 % в случае этилцикло-пентана и 27 % в случае транс - 1.2. - диметилциклопентана. Согласно этим данным, скорость ароматизации циклопентановых углеводородов даже несколько меньше, чем замещенных пентанов. Авторы считают, что условия, последующие за образованием 5-членного цикла из замещенных пентанов, вследствие близкого и удобного расположения на катализаторе водорода, только что отщепившегося в результате реакции циклизации, благоприятствуют последующему расщеплению этого кольца. [19]
В случае более высокомолекулярных гомологов циклогек-сана и циклопентана равновесие сдвинуто еще в большей степени в сторону циклогексановых углеводородов. Так, ме-тилциклогексан при его температуре кипения ( 100) уже совсем не изомеризуется в циклопентановые углеводороды. Наоборот, этилциклопентан и диметилциклопентаны в присутствии хлористого алюминия при той же температуре почти нацело превращаются в метилциклогексан. [20]
Изучено также поведение алкилциклопропанов н алкилциклобутанов в присутствир. Этилциклобутан дал некоторое количество метилциклспентана и циклогексана плюс большое количество полимера. Изопропилциклобутан интенсивно изомеризовался в метил-циклогексан, некоторые диметилциклопентаны и лишь незначительно полимеризовался. [21]
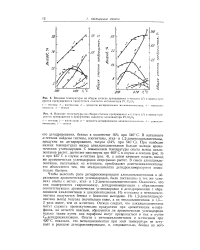
С повышением температуры опыта выход цикло-пентанов растет, достигает максимума при 460 С в случае н-гексана ( рис. 3) и при 425 С в случае н-гептана ( рис. 4), а затем начинает падать; выход же ароматических углеводородов непрерывно растет. В смеси алкилциклопентанов, получаемых из н-гептана, преобладают диметилциклопентаны; это объясняется тем, что этилциклопентан дегидроизомеризуется значительно быстрее. [23]
Помимо этого процесса, направленного на повышение качества низкооктановых бензино-лигроиновых фракций, циклизация широко применялась для синтеза толуола во время второй мировой войны, когда ресурсы толуола из каменноугольного сырья оказались недостаточными для снабжения вооруженных сил взрывчатыми веществами. Обычно в качестве сырья применяли выделенные сверхчеткой перегонкой узкие фракции, содержавшие значительные количества метилциклогек-сана, диметилциклопентана и этилциклопентана. Перечисленные компоненты сырья практически полностью превращались в толуол. Участие соответствующих парафиновых углеводородов, как и-гептан или метилгексан, в образовании толуола было крайне незначительным, вероятно, по рассмотренным выше причинам. [24]
В связи с вопросом о возможности образования ароматических углеводородов из пятичленных замещенных нафтенов интересно исследование Фрайеса, который подвергал дегидрогенизации смесь из метилциклогексаиа, содержавшего меченый атом Си диметилциклопентана и нормального гептана. Дегидрогенизация велась на алюмомолибденовом катализаторе, который не действовал на гептан в сторону дегидроциклизации. Выяснилось, что только половина полученного толуола образовалась из метилциклогексаиа, откуда следует, что другая половина могла образоваться только из диметилциклопентана за счет расширения кольца с образованием метилциклогексана. [25]
Румянцевой и М. И. Батуева было изучено расщепление метилциклопентана 1о и двузамещенных гомологов циклопентана. В этих работах было показано, что скорость данной реакции зависит от строения молекулы углеводорода, иначе говоря, от числа заместителей и от их взаимного расположения. Быстрее всех гидрируется цик-лопентан; метилциклопентан - приблизительно в полтора раза медленнее, причем, хотя расщеплению с присоединением водорода подвергаются все связи пятичленного кольца, но преимущественно отстоящие через один углеродный атом от углерода, связанного с заместителем. В 1.1 - диметилциклопентане пяти-членное кольцо расщепляется примерно с такой же скоростью, как в метилциклопентане; 1.2 - диметилциклопентан реагирует в пять раз, а 1.3 - диметилциклопентан - в 10 - И раз медленнее, чем циклопентан. На всех этих примерах было показано, что связи, соседние с углеродом, несущим заместитель, разрываются под влиянием водорода в присутствии катализатора в наименьшей степени, а в случае 1.1 - диметилциклопентана, у которого два заместителя находятся у одного и того же атома углерода, связи, соседние с этим углеродом, не разрываются совсем. [26]
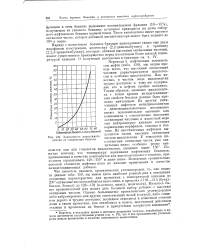 |
Зависимость допустимого сжатия от содержания бензола. [27] |
Переходя к нафтеновым компонентам нефти ( табл. 158), мы видим прежде всего, что высокими октановыми числами характеризуются циклогек-сан и особенно циклопентан. Как известно, в чистом виде циклопентан трудно доступен; к тому же содержание его в нефтях крайне невелико. Таким образом, значение циклопента-на с точки зрения антидетонационных свойств бензина должно быть признано ничтожным. Из других пяти-членных нафтенов метилциклопентан и диметилциклопентаны несомненно имеют положительное значение как компоненты с относительно высокими октановыми числами; в известной мере они нейтрализуют влияние соседних нормальных парафинов, гексана и гептана. Из шестичленных нафтенов выделяется своим высоким октановым числом циклогексан. Понятно поэтому, что температуру выкипания нафтеновых бензинов, применяемых в качестве компонентов для высокооктанового топлива, приходится ограничивать 140 - 150 и даже ниже. Вследствие сравнительно высокой стоимости нафтены пока не находят применения в качестве антидетонационных добавок. [28]
Реакция каталитической дегидрогенизации нафтенов была проверена Фрайесом [61] при помощи меченых атомов. На установке, производившей толуол из смеси метилцикло-гексана, диметилциклопентана и - гептана ( на алюмомолиб-деновом катализаторе) был применен метилциклогексан, меченый радиоактивным углеродом - С14 в метильной группе. Оказалось, что только половина толуола образовалась из метилциклогексана. Вторая половина могла образоваться только из диметилциклопентана, ибо катализатор не действовал в направлении превращения гептана в толуол. [29]
Эта зависимость показана на рис. 1, из которого следует, что содержание компонентов гемдиметиловой группы в диметилпентанах прямо пропорционально содержанию компонентов гемдиметиловой группы в диметилциклопентанах. Установленная закономерность свидетельствует об общем происхождении диметилпентанов и диметилцикло-пентанов; вероятно, что исходными материалами для этих соединений явились каротиноиды или другие терпеноиды с гемдиметило-выми группами. Если бы в процессе перегруппировки происходило энергичное отщепление метилового радикала из гемдиметиловой группы, то в данной нефти можно было бы ожидать низкие содержания 2 2 - и 3 3-диметилпентанов, а также 1 1-диметилциклопентана. При менее энергичном отщеплении метилового радикала как в диметилпентанах, так и в диметилциклопентанах содержание компонентов с гемдиметиловыми группами должно увеличиваться. [30]
Страницы: 1 2 3