Взаимодействие - анион
Cтраница 2
Анионная полимеризация капролактама протекает ступенчато при взаимодействии аниона капролактама с конечными имидными группами растущей цепи. [16]
Из этих данных можно видеть, что взаимодействие аниона SigOis ( OH) 2 c NH2 - rpynnaMH лигандов осуществляется как опосредованно - через молекулы воды, так и прямыми водородными связями между атомами азота этилендиаминового комплекса и атомами кислорода кремнекислородного радикала. [17]
Как и взаимодействие анионов с металлом электрода, взаимодействие анионов с реагирующими частицами, если оно имеет характер притяжения, вообще говоря, не может быть сведено к чисто электростатическим эффектам; в поверхностном слое необходимо учитывать, как и при образовании комплексов в объеме раствора, возможность возникновения всех форм химической связи. [18]
 |
Зависимость массы покрытия. [19] |
При подкислении водного раствора пленкообразующего или в результате взаимодействия полимерного аниона с ионом металла ( при добавлении электролитов в виде солей металлов) полимер становится водонерастворимым. [20]
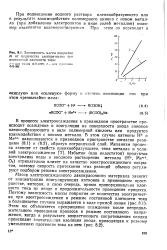 |
Зависимость массы покрытия т от количества электричества при постоянной плотности тока. [21] |
При подкислении водного раствора пленкообразующего или в результате взаимодействия полимерного аниона с ионом металла ( при добавлении электролитов в виде солей металлов) полимер становится водонерастворимьтм. [22]
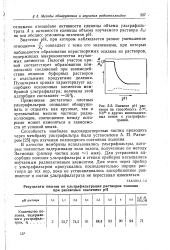 |
Влияние рН раствора на способность Zr96, Mb95 и других многовалентных ионов к ультрафильтрации. [23] |
Пологий участок кривой соответствует образованию комплексных соединений при взаимодействии анионов буферных растворов с отдельными продуктами деления. [24]
Реакция протекает через соединение IV, представляющее собой результат взаимодействия аниона диметилсульфоксида с одной из карбонильных групп. [25]
Это явление, вероятно, также связано с различием во взаимодействии аниона с водой. Действительно, чем более прочна связь аниона с водой, тем большим должно быть влияние температуры. При гидратации катионов характер взаимодействия зависит от соотношения потенциала ионизации металла и молекулы воды [26] и это взаимодействие является либо электростатическим, либо донорно-акцепторным. О взаимодействии же анионов с водой имеются противоречивые мнения. Согласно [27, 28], взаимодействие имеет чисто ион-дипольный характер и соответствующие водородные связи не образуются. С другой точки зрения [29-31], как в кристаллогидратах, так и в водных растворах образуются водородные связи с различными значениями энергий. Так, согласно [32], энергия связи сульфат-иона с водой составляет около 6 ккал / связь, а перхлорат-иона около 2 ккал / связь. Образование водородных связей анионов с водой, очевидно, обусловливает сильное их влияние на извлечение перренатов. [26]
Вопросы, связанные с подвижными атомами или группами, отщепляющимися в результате взаимодействия анионов целлюлозы с активными группировками, уже обсуждались. [27]
Растворение металла заключается или в переходе его ионов в раствор, или во взаимодействии анионов раствора с металлом. Ионы О снижают проницаемость пленки для катионов и для анионов и тормозят и тот и другой возможный вид растворения металла. Здесь еще раз сказывается ионный характер пассивирующего кислорода, что и приводит в уменьшению анионных и катионных вакансий в пленке. [28]
Природа растворителя оказывает большее влияние на скорость реакции, чем на константы равновесия при взаимодействии анионов с ионами карбо-ния. Это значит, что протекание этих реакций определяют специфические взаимодействия растворителя с переходным состоянием, отличные от взаимодействий, которые происходят в основном состоянии. В то же время реакционная способность N-метилимидазола по отношению к тг-нирофенилацетату всего лишь в два раза превышает реакционную способность аммиака, хотя аммиак является в 100 раз более основным нуклеофилом. [29]
При сопоставлении двух границ раздела: раствор - воздух и раствор - ртуть наглядно видно взаимодействие анионов с металлом при их специфической адсорбции на электроде. Такие зависимости называют изотермами двумерного давления. [30]
Страницы: 1 2 3 4