Взаимодействие - карбонат
Cтраница 1
Взаимодействие карбонатов и бикарбонатов щелочных металлов или аммония с солями уранила приводит к образованию комплексных ионов типа: [ UO2 ( CO3) 3 ] 4 -, [ UO2 ( CO3) 2 ( H2O) 2 ] 2 - и др. Наиболее важными в технологии производства урана являются карбонатные комплексные соли натрия и аммония. [1]
Взаимодействие карбоната бария с пятиокисью ниобия при неизотермическом нагревании сопровождается появлением на кривой ДТГ максимумов скорости выделения двуокиси углерода при 670 - 690 и 960 - 980 С. В изотермических условиях реакция протекает с заметной скоростью при температурах выше 650 С. [2]
Процессы взаимодействия карбоната бария с окислами подгруппы ванадия удовлетворительно описываются указанными уравнениями в пределах до 70 - 80 % превращения исходных компонентов в конечный продукт реакций. [3]
При взаимодействии карбоната калия с кислотами образуются соли этих кислот с выделением диоксида углерода. [4]
При взаимодействии карбоната циркония с карбонатом аммония образуется ( ЫН4) з2гОН ( СОз) з - 2Н2Р - бесцветное кристаллическое вещество, растворимое в воде и нерастворимое в этаноле. [5]
При взаимодействии карбоната калия с хлороводородом образуются хлорид калия, диоксид углерода и вода. Определите количество хлорида калия и объем диоксида углерода ( при н.у.), которые образуются из 24 82 г хлороводорода. [6]
Так как при взаимодействии карбонатов с кислотами происходит связывание ионов водорода, карбонатами, как и основаниями, можно пользоваться для нейтрализации кислот. Так, известняк СаСОз в размолотом виде применяется для известкования почв при излишней их кислотности. [7]
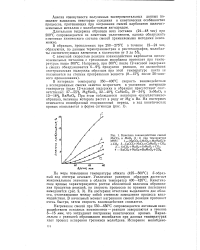 |
Кинетика взаимодействия смесей МеСОз и МоО3 при температуре 375 С. 1 - MgCO3 Mo03MgMoO4. [8] |
С заметной скоростью реакции взаимодействия карбонатов щелочноземельных металло в с трехокисью молибдена протекает при температурах выше 300 С. [9]
Хлорид рубидия RbCl получают взаимодействием карбонатов с соляной кислотой, хорошо растворим в воде. [10]
 |
Пеногенератор высокократной пены ГВП-600. / - корпус. 2-распылитель. 3 - пакет сеток. 4-насадка. [11] |
Химическая пена образуется при взаимодействии карбоната или бикарбоната натрия с кислотой в присутствии пенообразователя. Пенообразующий порошок состоит из сухих солей ( сернокислого алюминия, бикарбоната натрия) и лакричного экстракта или другого пенообразующего вещества. При взаимодействии с водой сернокислый алюминий ( или другие сернокислые соли), бикарбонат натрия и пенообразователь растворяются и немедленно реагируют с образованием диоксида углерода. [12]
Химическая пена образуется при взаимодействии карбоната или бикарбоната с кислотой в присутствии пенообразователя. Практически такую пену получают в эжекторных переносных приборах ( пеногенераторах) из пенопорошка и воды. Пенопорошок состоит из сухих солей ( сернокислого алюминия, бикарбоната натрия) и лакричного экстракта или другого пенообразующего вещества. При взаимодействии с водой сернокислый алюминий ( или другие сернокислые соли), бикарбонат натрия и пенообразователь растворяются и немедленно реагируют с образованием двуокиси углерода. [13]
Химическая пена образуется при взаимодействии карбоната или бикарбоната с кислотой в присутствии пенообразователя. Такую пену получают в эжекторных переносных приборах ( пе-ногенераторах) из пенопорошка и воды. Пенопорошок состоит из сухих солей ( сернокислого алюминия, бикарбоната натрия) и лакричного экстракта или другого пенообразующего вещества. При взаимодействии с водой сернокислый алюминий ( или другие сернокислые соли), бикарбонат натрия и пенообразователь растворяются и вступают в реакцию, образуя диоксид углерода. [14]
 |
Пеногенератор высокократной пены ГВП-600. 1 - корпус. 2 - распылитель. 5 - пакет сеток. 4-насадка. [15] |
Страницы: 1 2 3 4