Взаимодействие - кремний
Cтраница 1
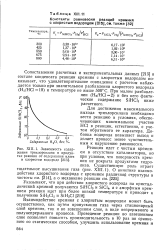 |
Зависимость содержания трихлорсилана в продуктах реакции от содержания влаги в хлористом водороде. [1] |
Взаимодействие кремния с хлористым водородом может быть осуществлено, как путем пропускания газа через стационарный слой кремния, так и во взвешенном слое, в виде непрерывного и полунепрерывного процесса. [2]
Взаимодействие кремния с углеродом приводит к образованию соединения SiC ( карбид кремния), обладающего рядом ценных свойств, благодаря которым карбид кремния находит все большее практическое применение. [3]
Взаимодействие кремния с органическими хлорпроизводными ( хлористым метилом, хлорбензолом, хлористым этилом и др.) является одним из основных способов синтеза органохлорсиланов. [4]
Взаимодействие кремния или ферросилиция с хлором приводит к получению SiCl. [5]
Взаимодействие кремния с хлористым водородом изучено в работах Андрианова. [6]
Реакции взаимодействия кремния и хлористого водорода являются поверхностно-каталитическими, в связи с чем большое значение имеет представление о механизме образо - WO BOO 800 1000 т, к вания трихлорсилана. [7]
При взаимодействии кремния с кислородом к двум его атомам переходят все четыре электрона третьего энергетического уровня ( третьей электронной орбиты) атома кремния. В результате создается прочная связь, определяемая преимущественно ионным взаимодействием атомов. При заполнении потенциальных дырок атомов кислорода и переходе электрона с высшего энергетического уровня на низший образуется избыток энергии, который расходуется в основном на приведение электронов в возбужденное состояние. Для взаимодействия атома кремния с атомом кислорода необходимо предварительно сильно их нагреть. Под влиянием тепловой энергии возбуждения атом кремния переводится в валентное состояние, и поэтому Si выделяет вследствие химической реакции еще большую энергию. [8]
При взаимодействии кремния с большинством металлов при высоких температурах образуются силиды металлических элементов разнообразного состава. Силиды могут быть получены также восстановлением оксида кремния ( IV) большим избытком соответствующего металла. [9]
При взаимодействии кремния с металлами образуются силициды ( Ca2Si, Mg2Si, BaSi2, Cr3Si, CrSi2 и др.), похожие во многом на карбиды. [10]
По-видимому, взаимодействие кремния с азотом происходит только на поверхности нагревателя. Нитрид кремния выделяется в печное пространство и осаждается на стенках печи. [11]
По-видимому, взаимодействие кремния с азотом происходит только на поверхности нагревателя. Нитрид кремния выделяется в печное пространство и осаждается на стенках печи. [12]
В результате взаимодействия кремния с углеродом при высоких температурах ( 1400 С) образуется полупроводниковое соединение - карбид кремния. [13]
Для возможности взаимодействия кремния со щелочами достаточны уже настолько ничтожные концентрации ионов ОН, что реакция медленно идет даже с водой, содержащей только следы щелочей, извлеченные из стекла. Так как образующаяся соль очень слабой кремневой кислоты в разбавленном растворе практически нацело гидролизована, концентрация ионов ОН по мере протекания реакции не уменьшается. Поэтому рассматриваемый процесс практически сводится к разложению воды кремнием, причем присутствующая в виде следов щелочь играет роль катализатора. [14]
Этилсиликаты получают взаимодействием четыреххлоряетого кремния с этиловым спиртом в условиях, исключающих возможность сильного гидролиза и полимеризации. Этилсиликаты в присутствии влаги медленно гидролизуются с образованием кремневых кислот, которые подвергаются одновременно дегидратации и полимеризации с образованием в качестве конечного продукта аморфного кремнезема. Этилсиликат не растворим в воде, но растворяется в этаноле, изопропаноле и в водных смесях этих спиртов. [15]
Страницы: 1 2 3 4