Ион-дипольное взаимодействие
Cтраница 1
Ион-дипольное взаимодействие подобно притяжению ионов, за исключением того, что оно более чувствительно к расстоянию ( 1 / г2 вместо / г, см. разд. Такое взаимодействие проявляется, например, при образовании сольватов ионов ( гидратов ионов - в водном растворе) в процессе растворения и диссоциации ионных кристаллов в полярном растворителе, например Na ( H2O) и F ( H2O) y в водном растворе NaF. Подобные сольваты ( гидраты) многих катионов металлов и некоторых анионов имеют вполне определенный состав в первой зоне сольватации ( гидратации), например [ Со ( Н2О) е ] 2 в воде и [ Co ( NH3) 6 ] 3 в жидком аммиаке. Для описания таких сольватов используется электростатическая теория кристаллического поля ( см. разд. [1]
Ион-дипольное взаимодействие проявляется при образовании гидратов ионов в процессе растворения ионных кристаллов в воде. [2]
Ион-дипольное взаимодействие проявляется при растворении электролитов в полярных растворителях. [3]
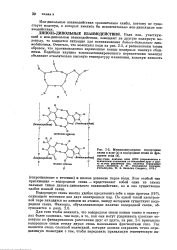 |
Межмолекулярные водородные связи в воде ( а и водородные связи во фрагменте гена ( б. [4] |
Ион-дипольные взаимодействия сравнительно слабы, поэтому не существует молекул, в которых имелись бы исключительно ион-дипольные взаимодействия. [5]
 |
Энтропия молекул воды в ближайшем окружении ионов ( а и коэффициент вязкости В в уравнении Джонсона-Дола ( б. [6] |
Отмеченное ион-дипольное взаимодействие наиболее характерно для гидратации катионов, при гидратации анионов со значительным зарядом или малым радиусом более типично присоединение молекул воды за счет водородных связей. [7]
 |
Схема растворения соли.| Растворение хлороводорода в воде. [8] |
Результатом ион-дипольного взаимодействия является переход соли в раствор. [9]
Диполь-дипольные или ион-дипольные взаимодействия проявляются тогда, огда полярные частицы или ионы, вводимые в систему, состоящую из молекул растворителя с постоянными ди-тюльными моментами, начинают притягивать к себе молекулы растворителя; эти силы Притяжения часто оказываются более значительными, чем силы взаимодействия между молекулами растворителя. Такая ситуация типична для воды и спиртов. [10]
В результате ион-дипольного взаимодействия свободные ионы, образующиеся из ионных пар, поляризуют вокруг себя молекулы растворителя. Картина ориентации диполей среды вокруг сферических ионов одинакова по всем направлениям. [11]
За счет сильного ион-дипольного взаимодействия с молекулой воды связь с ионами кислорода ослабляется, возникает сжатие вдоль оси к центру большой полости. [12]
Она обусловлена диполь-дипольным, ион-дипольным взаимодействием, образованием координационных и реже водородных связей. [13]
Ионы за счет ион-дипольного взаимодействия способны притягивать полярные молекулы других веществ. [15]
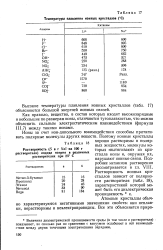
Страницы: 1 2 3 4