Ион-дипольное взаимодействие
Cтраница 3
Поскольку гидратация лишь приближенный способ описа ния ион-дипольного взаимодействия, то гидратное число должно возрастать с энергией взаимодействия ЫГИДР. [31]
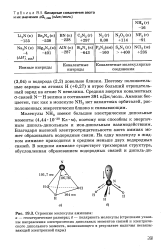 |
Бинарные соединения азота и их значения ДО, 29В ( кДж / моль.| Строение молекулы аммиака. [32] |
Клфм), поэтому они способны к энергичным диполь-дипольным и ион-дипольным взаимодействиям. Благодаря высокой электроотрицательности азота аммиак может образовывать водородные связи. На одну молекулу в жидком аммиаке приходится в среднем меньше двух водородных связей. [33]
Пропанол осуществляет с окисленной поверхностью диполь-дипольное взаимодействие, ион-дипольное взаимодействие и водородные связи. [34]
Когда в системе имеются ионы, то преобладает ион-ионное и ион-дипольное взаимодействие. Если между незаряженными частицами одновременно проявляется ориентацией-ное, индукционное и дисперсионное взаимодействие, то доля дисперсионного взаимодействия обычно максимальна. Лишь у молекул с большим Ц и малой а преобладает диполь-дипольное взаимодействие. Наряду с силами притяжения в каждом случае взаимодействия двух частиц проявляются также и силы отталкивания, которые на расстояниях, меньших равновесного расстояния Го, преобладают. [35]
Однако эти энергетические вклады меньше, чем вклад ион-дипольного взаимодействия, и имеют существенное значение главным образом для неполярных растворителей. [36]
Поэтому в протонных растворителях на сольватации анионов сильно сказываются ион-дипольное взаимодействие и водородная связь. В апротонных растворителях, например в диметил-сульфоксиде, водородная связь отсутствует и сольватация анионов ослаблена. Размеры катионов обычно меньше размеров анионов. Поэтому первые более склонны к диполь-дипольному взаимодействию. На это взаимодействие накладывается комплексообразование, которое можно рассматривать как разновидность сольватации и которое вносит значительный вклад в энергию сольватации. [37]
Педерсен предположил, что образование комплексов может быть следствием ион-дипольного взаимодействия между катионами и симметрично расположенными в полиэфирном кольце отрицательно заряженными атомами кислорода. [38]
Это обусловлено тем, что при одинаковой абсолютной величине ион-дипольного взаимодействия ионизированной функциональной группы органической молекулы с диполями воды в растворе относительная доля этого взаимодействия в общем балансе сил уменьшается. [39]
 |
Сравнение кислотности в воде и ДМСО. [40] |
В ДМСО физическая картина сольватации иная; здесь следует учитывать ион-дипольное взаимодействие, взаимодействие с индуцированным диполем и так называемые силы Лондона. По теории Лондона, даже неполярные молекулы, например благородных газов, притягиваются друг к другу, поскольку неполярность - это качество, усредненное по времени, но в любой данный момент времени электроны локализованы несимметрично, так что центр отрицательного заряда нейтральной молекулы не совпадает с центром положительного заряда ядра. [41]
Считают, что при адсорбции воды на алюмосиликатах имеет место ион-дипольное взаимодействие. [42]
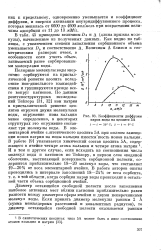 |
Коэффициенты диффузии паров воды на цеолите 5А. [43] |
Полярные молекулы воды энергично сорбируются на кристаллической решетке цеолита вследствие ион-дипольного взаимодействия и группируются прежде всего вокруг катионов. По данным рентгеноструктурных исследований Тейлора [31, 32] ион натрия в кристаллической решетке цеолитов окружен двумя молекулами воды, окружение иона кальция менее определенно, в некоторых структурах это окружение составляет три молекулы воды. В элементарной ячейке слнтетического цеолита 5А при полном замещении ионов натрия на ионы кальция имеется шесть ионов кальция. И в том и другом случае, если исходить из соотношения числа молекул воды и катионов по Тейлору, в первом слое водяной оболочки, выстилающей поверхность сорбционной полости, содержится приблизительно 18 - 20 молекул воды, что составляет 19 - 20 % от веса элементарной ячейки. [44]
Кроме того, образовавшиеся ионы Н3О к С1 - вступают в ион-дипольное взаимодействие с избыточными молекулами воды. [45]
Страницы: 1 2 3 4