Ионное взаимодействие
Cтраница 1
Ионные взаимодействия в молекуле характеризуются числом окружающих соседей. В молекуле NaGl каждый ион имеет одного соседа, а в кристалле NaCl, который можно рассматривать как одну большую молекулу, каждый ион натрия окружен шестью ионами хлора. В кристалле CsCl каждый ион хлора окружен восемью ионами цезия. [1]
Ионные взаимодействия в молекуле характеризуются числом окружающих соседей. В молекуле NaCl каждый ион имеет одного соседа, а в кристалле NaCl, который можно рассматривать как одну большую молекулу, каждый ион натрия окружен шестью ионами хлора. В кристалле CsCl каждый ион хлора окружен восемью ионами цезия. [2]
Ионное взаимодействие может значительно изменить состав пересыщенного раствора, а следовательно, реакцию осаждения кальцита. Степень ионной ассоциации в экспериментальных растворах можно оценить, если известны общий состав раствора, рН и термодинамические константы устойчивости. Образование ионных пар в пересыщенных растворах, содержащих фосфат, глицерофосфат-ионы или магний, не оказывает заметного действия на кинетику роста кристаллов. [3]
Здесь ионное взаимодействие, вероятно, имеет преобладающее значение в определении отклонений - от идеального поведения. [4]
Силы ионного взаимодействия относятся к числу наиболее эффективных. Эти силы проявляются при хроматографировании на сильнокислотных или сильноосновных сорбентах или ионооб-менниках. Для уменьшения воздействия ионных сил следует применять системы растворителей с высокой диэлектрической проницаемостью и большим дипольным моментом ( вода, полярные органические растворители), молекулы которых способны экранировать ионы, снизить заряд и тем самым обеспечить подвижность ионов. Недостаток этих систем состоит в том, что они обладают высокой хроматографической активностью и не позволяют хорошо разделить вещества, отличающиеся друг от друга менее полярными группами в молекуле. Поэтому в большинстве случаев применяют такие сорбенты и системы растворителей, в которых образование ионов подавляется. [5]
Помимо описанных ионных взаимодействий, в хроматографическом процессе в большей или меньшей степени участвуют и другие виды взаимодействия вещества с сорбентом, рассмотренные ранее в других хроматографических методах. Свой мклад неизбежно вносят гель-фильтрация, гидрофобное взаимодействие с материалом матрицы, адсорбция за счет водородных связей и ван-дер-ваальсо-вых сил и, наконец, распределительная хроматография. Последняя, в частности, обусловлена своеобразным явлением распределения ионов соли между подвижной жидкой фазой элюента вне гранул обменника и неподвижной жидкостью внутри гранул. Ионы соли, заряженные одноименно с неподвижными ионами обменника, в определенной степени выталкиваются из гранул, в результате чего концентрация ионов в жидкости внутри и вне гранул может быть не вполне одинаковой. [6]
Если преобладает ионное взаимодействие, то целесообразно описывать связь с позиций электростатических и поляризационных представлений. Если же преобладает ковалентное взаимодействие, то целесообразно описывать связь с точки зрения учения о ковалентной связи. [7]
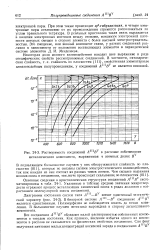 |
Растворимость соединений ЛШВУ в расплаве собственного металлического компонента, выраженная в атомных долях В. [8] |
Некоторая доля ионного взаимодействия находит свое выражение в ряде специфических свойств рассматриваемых соединений. [9]
О роли ионных взаимодействий в квадруполь - ной релаксации ядерных спинов диамагнитных ионов. [10]
Описанная картина ионных взаимодействий веществ с обменником подсказывает два главных способа управления силой этих взаимодействий ( прочностью ионной сорбции), а следовательно, и значениями коэффициентов распределения компонентов смеси веществ между фазами, и возможностью их хроматографического фракционирования: во-первых, управление степенью ионизации ионогенных групп обменника и вещества путем вариации рН буфера и, во-вторых, регулирование степени блокирования их зарядов путем выбора концентрации соли в элюенте. Рассмотрим эти способы подробнее. [11]
Попытки поляризационного расчета ионных взаимодействий без учета всех этих обстоятельств обычно не приводили к хорошим результатам. [12]
В отличие от ионного взаимодействия в этом случае образование восьмиэлектронных оболочек не сопряжено с возникновением зарядов. Кроме того, электронная пара связывает данный атом только с одним-единственным определенным партнером по связи. Поэтому валентный штрих в формуле ( 1.2 а) вполне уместен с точки зрения электронной теории. Он всегда представляет два электрона и отражает физическую реальность. [13]
Однако вклад энергии многочастичных ионных взаимодействий сильно уменьшается, когда ионы имеют одинаковые размеры, и величина этого вклада становится практически пропорциональной константе Маделунга. Так как константы Маделунга решеток типа CsCI и NaCl различаются только на 1 %, чувствительность упаковки к указанному эффекту намного меньше, чем это требуется для объяснения стабильности кристаллов. Были сделаны и другие попытки учесть многоионные взаимодействия, но они уже не имели прямого отношения к проблеме стабильности. [14]
Однако вклад энергии многочастичных ионных взаимодействий сильно уменьшается, когда ионы имеют одинаковые размеры, и величина этого вклада становится практически пропорциональной константе Маделунга. Так как константы Маделунга решеток типа CsCl и NaCl различаются только на 1 %, чувствительность упаковки к указанному эффекту намного меньше, чем это требуется для объяснения стабильности кристаллов. Были сделаны и другие попытки учесть многоионные взаимодействия, но они уже не имели прямого отношения к проблеме стабильности. [15]
Страницы: 1 2 3 4