Ионное взаимодействие
Cтраница 2
Принцип Бренстеда о специфическом ионном взаимодействии ( [72-75]; см. также главу XIV в работе [15]) позволяет выбирать средние коэффициенты активности, которые могут с большим основанием представлять уа в отдельных смешанных растворах. [16]
 |
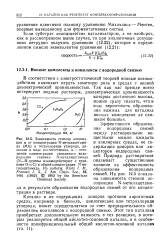
Зависимость коэффициента активности тростникового сахара ( / и хлорида лития ( 2 от их концентрации в водном растворе. [17] |
Чтобы описать ион - ионное взаимодействие, необходимо знать распределение ионов в растворе и природу сил, действующих между ионами. [18]
Перемещение это происходит вследствие ионных взаимодействий, механизм которых сложен. Однако интенсивность этих перемещений вне зависимости от причин их возникновения сомнений не вызывает. [19]
Для вычисления ион - ионного взаимодействия представляет интерес не общий потенциал ф, а та его часть ра, которая создается ионной атмосферой в месте расположения центрального иона. Величина Фа называется потенциалом ионной атмосферы. [20]
Возможность весьма существенного вклада ионных взаимодействий в задержание белков при гель-фильтрации на силикагельных матрицах недавно убедительно продемонстрировали Румелиотис и Унгер, работая с колонкой Li Chrosorb-DIOL. [21]
Косселя химическая связь объяснена ионным взаимодействием. [22]
В соответствии с электростатической теорией ионные взаимодействия начинают играть заметную роль в средах с низкой диэлектрической проницаемостью. [24]
Для каркасных структур более характерным будет ионное взаимодействие между самим каркасом и атомами, находящимися вне каркаса, так как нейтральный молекулярный каркас ничем не отличается от координационных структур. Хорошим примером ионных каркасных структур может служить приведенная выше Структура NaW03 или же структура полевых шпатов. Структура ортоклаза KJAlSiaOs ] похожа на структуру одной из модификаций SjO2: расположение атомов в каркасном мотиве [ AlSisOs ] очень сходно с расположением их в структуре 5Ю2, так как в полевых шпатах алюминий занимает те же места в структуре, что и кремний. Но замена Д атомов кремния на алюминий придает каркасу [ AlSisOs ] заряд, равный единице. [25]
Поскольку Н20 оказывает сильное влияние на ионное взаимодействие, образование небольших количеств Н20 в таких системах всегда играет огромную роль, так как может значительно влиять на результаты кинетических и термодинамических исследований. Этот эффект заслуживает более полного исследования. [26]
Для каркасных структур более характерным будет ионное взаимодействие между самим каркасом и атомами, находящимися вне каркаса, так как нейтральный молекулярный каркас ничем не отличается от координационных структур. Хорошим примером ионных каркасных структур может служить приведенная выше структура NaWOs или же структура полевых пшатов. [27]
Соответственно с уменьшением полярности системы ( ионные взаимодействия заменяются на взаимодействия за счет водородных связей) уменьшаются прочность и остаточное сжатие вулканизатов. Для достижения оптимальных механических свойств вулканизаты с амидными сшивками необходимо усиливать техническим углеродом. Подобные, хотя и более сложные структуры получают, применяя полиамины, соединения, содержащие амино - и иминогруппы, а также N-содержащие полимерные смолы. Этиленгликоль и аналогичные ему вещества способствуют диспергированию вулканизующего агента и тем самым улучшают свойства вулканизатов. Амидные поперечные связи образуются также при взаимодействии карбоксильных групп эластомера с полиизоцианатами [58; 60; 75; 76], например с л-фенилендиизоцианатом, л-толуилендиизоцианатом, гексаметилендиизоцианатом, 1 3-бис ( 3-изоцианат-я - толил) мочевиной. Реакция протекает при комнатной температуре с выделением диоксида углерода из промежуточного продукта реакции. Она применяется только для вулканизации клеев и пропиточных составов для пористых материалов. При введении изоцианатов на вальцах наблюдается сильная подвулканизация смесей. [28]
Облегчает задачу теории то, что дальние электростатические ионные взаимодействия в растворах зависят только от заряда ионов и не зависят от их природы. Предполагая, что ионы являются точечными зарядами в непрерывной среде с диэлектрической постоянной, такой как у воды, Дебай и Хюккель получили теоретическое выражение для коэффициента активности иона в разбавленных растворах [ см. раздел XII. Для растворов электролитов многочисленные измерения были выполнены не только в воде, но и в других растворителях с иными диэлектрическими постоянными и при различных - температурах. В каждом случае соотношение Дебая - Хюккеля выполняется, когда раствор, достаточно разбавлен. Дальние взаимодействия являются в основном электростатическим притяжением противоположно заряженных ионов и, следовательно, в разбавленных растворах активность иона меньше, чем его концентрация. [29]
Сульфокислоты сорбируются на ионитах за счет сильного ионного взаимодействия и молекулярной сорбции. [30]
Страницы: 1 2 3 4